Опорний конспект
на тему:
"Ароматичні вуглеводні"
Виконав:
учень 10 - А класу
середньої школи № 96
Коркуна Дмитро
Ненасичені вуглеводні – це органічні сполуки, що складають ся з Карбону і Гідрогену, в яких атоми Карбону не повністю насичені атомами Гідрогену.
Загальна формула етиленових вуглеводнів – CnH2n
Загальна формула ацетиленових вуглеводнів CnH2n-2
Гомологи етилену Гомологи ацетилену:
С2H4 – етилен; C2H2 – ацетилен;
С3H6 – пропен; C3H4 – пропин
C4H8 – бутен; C4H6 – бутин
І т .д І т д
Радикали: СН3 – метил; С2Н5 – етил; С3Н7 пропіл;
Радикал – це атом або група атомів, що містить неспарені електрони
Етилен:
С2Н4 Н2С – СН2 Н : С : : С : Н
СН2 Н : С : : С : Н
Н Н
молекулярна струтурна електронна формули
Ацетилен:
С2Н2 НС CH H : C 
 C : H
C : H
H H
Молекулярна структурна електронна формули
Фізичні властивості:
Етилен – безбарвний газ, майже без запаху, малорозчинний у воді, трохи легший за повітря
Ацетилен – безбарвний газ, без запаху, малорозчинний у воді.
Хімічні властивості:
як і інші вуглеводні, етилен і ацетилен горять на повітрі з утворенням оксиду карбону (ІV) і води:
СН2 = СН2 +3 О2 2СО2 + Н2О
2СН СН+5О3 4СО2 +2 Н2О ▲Н = 1307 к Дж.моль
СН4 – W( C) =75%; C2H4 – W( C) =86 %; C2H2 - W( C) = 92%
Чим менша кількість С, тим світліше полум'я
Гідрування – приєднання водню
Н2С = СН2 +Н2  (t0, pt, N) H3C – CH3
(t0, pt, N) H3C – CH3
Гідратація – приєдання води
Н2С = СН2 + Н2О  (t0 , H2SO4) CH3 – CH2 OH
(t0 , H2SO4) CH3 – CH2 OH
4. Якісні реакції
Неповне окиснення Н2С = СН2 +[O] 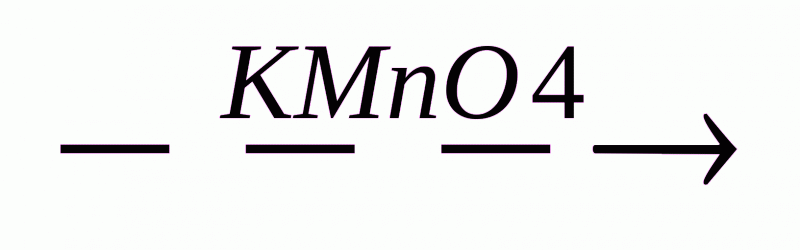 CH2 – OH
CH2 – OH
|
CH2 – OH
Галогенування – приєднання галогеноводню
Н2С = СН2 +Сl2 CH2Cl –CH2Cl
6. приєднання галогеноводню, правило Марковніка. При взаємодії ненасичених вуглеводнів з галогеноводнями атом Гідрогену приєднується до більш гідрогенізованого атома Карбону а атом Хлору – до менш гідронізованого
Н




 3С – СН СН2 +HCl HC3 –CHCl –CH3
3С – СН СН2 +HCl HC3 –CHCl –CH3
Дегідрування
Н2С = СН2 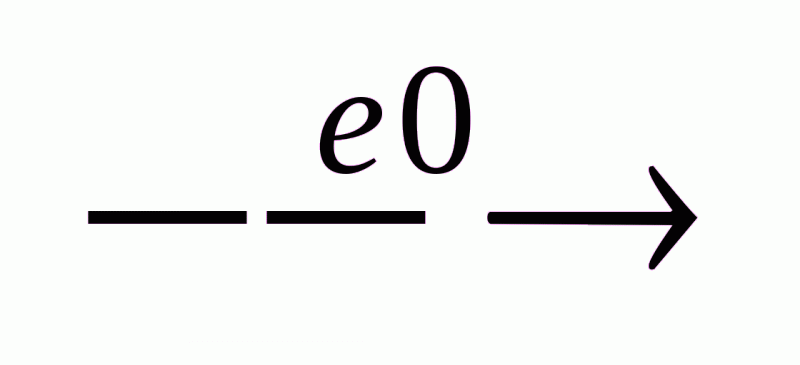 Н СН + Н2
Н СН + Н2
Характерна ізомерія за місцем розташування подвійного зв'язку:
а) ізомери
СН3 – СН = СН2 – СН3 – 2 бутен
СН2 = СН – СН2 – СН3 – 1 бутен
б) Ізомерія карбонового скелету
СН2 = С – СН3
|
CH3
-1-
Добування ецителену і ацетилену
Етилен та його гомологи утворюють в процесі переробки вуглеводнів, що містяться в нафті. Утворення може відбуватися у результаті термічного розщеплення ненасичених вуглеводнів,.
СН3 –СН2 – СН2 – СН2 – СН3 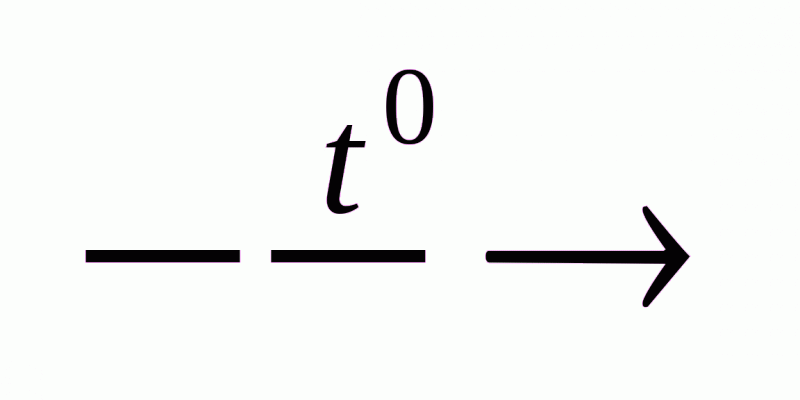 СН2 СН2 + СН3 –СН2 – СН3
СН2 СН2 + СН3 –СН2 – СН3
Ацетилен, що використовуэться для зварювальних робіт, добувають часто на місці в результаті взаємодії карбіду кальцію з водою: СаС2 + 2Н2О НС СН +Са(ОН)2
Карбід кальцію добувають в результаті нагрівання в електропечах суміші вапна СаО та коксу до температури 2500 0 С: СаО + 3С СаС2 +СО
Економічно вигідніше добувати ацетилен з метану нагріванням до температури 15000 С.
2СН4 НС СН + 3Н2
Застосування етилену і ацетилену
З етилену добувають поліетилен, етиловий спирт. Продукт приєднання хлору до етилену –1,2 -дихлорометан є розчинником і засобом знищення шкідників. А продукт приєднання хлороводню – хлороетан є анестезійною речовиною.
Ацетилен використовують для освітлення, для газового різання і зварювання металів. Ацетиленове кисневе полум'я має температуру 2800о С і легко плавить сталь. З ацетилену добувають вихідні речовини для виготовлення пластмас і синтетичних каучуків, він є сировиною для синтезу оцтової кислоти.
-2-
Ароматизовані вуглеводні – органічні сполуки, що містять у своєму складі бензольні ядра , у яких можуть бути насичені або ненасичені бічні ланцюги.
Загальна формула – СnH2n-6
гомологи бензолу:
бензол – C6H6; тонуол – C7H8 ; ксилол – C8H10; стирол – C9H12.
Бензол:
С6Н6 СН2 = СН –С С–СН = СН2 або СНС–СН2–СН2–cCH
Молекулярна структурні формули
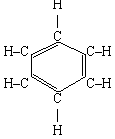
Формула А. Кекуле
У 1845 р. німецький учений А. Кекуле зппропонував формулу, що найкраще відобразила рівноцінність і атомів Карбону, і атомів гідрогену
П
ісля з'ясування електронної будови молекули бензолу, формулу почали записувати так:
Фізичні влстивості бензолу:
За звичайних умов бензол – рідина зі специфічним запахом, tкип. 80о С, уводі практично нерозчинний, хоча є розчинником багатьох органічних речовин.
Хімічні властивості:
Бензолу характерні реакції заміщення і приєднання:
реакція горіння
2С6Н6 +15О2 12СО2↑ + 6Н2О
Бромування:
Б-Н +Br2 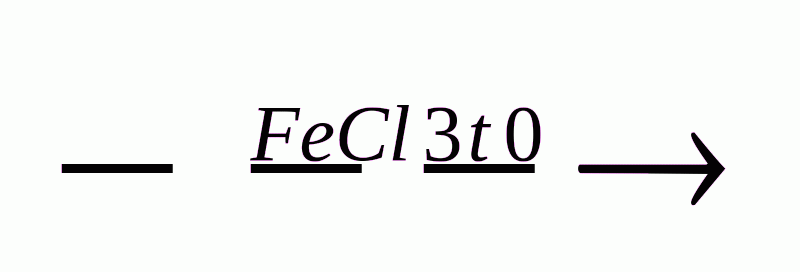 Б-Br +HBr;
Б-Br +HBr;
Нітрування:
Б-Н + НО–NO2 (Н2SO4) Б-NO2 + H2O
Реакції приєднання:
а
Б+3Cl2(n,v)
Cl2
Cl2
Cl2
Cl
) Хлорування:
б
Cl2
Cl
)Б+3Н2

(k,H2C) C6H12
Добування
меридизація ацетилену:
3НССН([C], 600o) Б
Дегідрування циклогексану
С6Н12  3Н2 + Б
3Н2 + Б
Застосування
Бензол є вихідною речовиною речовиною для синтезу величезної кількості неорганічних речовин. Серед них – барвники, лікарські препарати, пахучі речовини, полімери, отрутохімікати, вибухові речовини. Бензол – базова сировина для прмислового органічного синтезу
-1-
Другие работы по теме:
Моніторинг водоймищ за основними показниками якості води
Антропогенний вплив на гідросферу. Джерела забруднення навколишнього середовища. Переваги і недоліки біоремедіації як методу очищення. Бактеріальна трансформація нафтових вуглеводнів. Нафтоокиснювальні властивості мікроорганізмів, методика їх вивчення.
Хімічна будова твердих горючих копалин
Реферат на тему: Хімічна будова твердих горючих копалин Складністю хімічного складу і будови вугілля,що є природною високомолекулярною сполукою, обумовлюється необхідність застосування для визначення його молекулярної структури і надмолекулярної організації комплексу фізичних, фізико-хімічних і хімічних методів дослідження.
Ароматичні вуглеводні сполуки
ВСТУП Назва ароматичні сполуки виникла на початку 19-го ст., коли були вперше відкриті сполуки цього типу при їх виділенні із рослинних смол і бальзамів, що мали дуже приємні запахи. І хоч пізніше виявилось, що в основної більшості ароматичних сполук, навпаки, запахи неприємні, однак назва збереглася.
Вклад в органічний синтез реакцій Чичибабина
Короткий нарис життя та творчого шляху відомого російського хіміка О.Є. Чичибабина, внесок в розвиток науки. Початок наукового шляху великого вченого, його навчання. Розвиток хімії піридинових сполук. Реакції з одержання діазосполук та гетероциклів.
Нрфтр
Реферат з хімії на тему: “Нафта” Виконав: учень 10-А класу середньої школи № 96 Коркуна Дмитро Львів 2000 Нафта – горюча корисна копалина, складна суміш вуглеводнів та невуглеводневих сполук. До нафти входять у різному співвідношенні насичені вуглеводні (парафіни), нафтени й ароматичні вуглеводні.
Нафта походження властивості видобуток перегонка крекінг
РЕФЕРАТ з хімії Нафта: походження, властивості, видобуток, перегонка, крекінг Походження нафти Питання про вихідну речовину, з якої утворилася нафта, про процеси нафтоутворення і формування нафти в концентрований поклад, у окремих покладах і родовищах дотепер ще не є остаточно вирішеними. Існує ряд думок як про вихідні для нафти речовини, так і про причини і процеси, що обумовлюють її утворення.
Крекінг нафти
Розгляд процесів з нерухомим шаром каталізаторів - методу Гудрі та процесу Термофору. Порівняльний аналіз каталітичної та термічної реакцій розщеплення вуглеводів, визначення їх природних каталізаторів; вивчення хімізму та механізму даних процесів.
Принципи одержання та використання алкінів
НОМЕНКЛАТУРА Відповідно до вимог ІUPAC назви алкінів утворюють шляхом замінення суфіксів -ан у назвах алканів на -ін (чи -ин) із зазначенням номера атома карбону, з якого починається потрійний звязок. Деякі алкіни частіше називають за тривіальною номенклатурою, наприклад:
Принципи одержання та використання алкінів
Номенклатура, електронна будова, ізомерія, фізичні, хімічні й кислотні властивості, особливості одержання і використання алкінів. Поняття та сутність реакцій олігомеризації та ізомеризації. Специфіка одержання ненасичених карбонових кислот та їх похідних.
Ароматичні вуглеводні
Опорний конспект на тему: "Ароматичні вуглеводні" Виконав: учень 10 - А класу середньої школи № 96 Коркуна Дмитро Ненасичені вуглеводні – це органічні сполуки, що складають ся з Карбону і Гідрогену, в яких атоми Карбону не повністю насичені атомами Гідрогену.
Алкани як паливо Октанове та цетанове число
Реферат з органічної хімії на тему Алкани як паливо. Октанове та цетанове число’ студентки 1 курсу факультету природничих наук Францевої Анастасії Природний газ і нафта являють собою, головним чином, суміші насичених вуглеводнів. Основною складовою природного газу є метан. Нафта являє собою суміш гомологів метану з числом вуглеців у ланцюзі від С1 до С30 - С40.
Переробка нафти і нафтопродуктів
Підготовка нафти до переробки: видалення розчинених газів та мінеральних солей, зневоднювання нафтової емульсії. Аналіз складу нафти та її класифікація за хімічним складом, вмістом та густиною. Первинні і вторинні методи переробки. Поняття крекінгу.
Процеси гідрування і дегідрування
Теоретичні основи та класифікація процесів гідрування і дегідрування. Кінетика і селективність реакцій гідрування-дегідрування. Дегідрування парафінів і олефінів. Хімія і технологія процесів гідрування. Технологія газофазного та рідинофазного гідрування.
Процеси алкілування вуглеводнів
Загальна характеристика процесів, класифікація реакцій алкілування. Алкілуючі хлорпохідні агенти, алкілування за атомом вуглецю. Хімія і теоретичні основи алкілування ароматичних з'єднань у ядро. Каталізатори, механізм, побічні реакції, кінетика процесу.
Склад та первинна переробка нафти
Склад і основні види нафти за вуглеводневим складом. Фракційний склад і вміст води та домішок в нафті. Процес первинної перегонки: типи установок, сировина та продукти. Вибір технологічної схеми переробки: простої, складної, з водяною парою, у вакуумі.
Процеси окиснення вуглеводнів
Характеристика процесів окиснення: визначення, класифікація, енергетична характеристика реакцій; окиснювальні агенти, техніка безпеки. Кінетика і каталіз реакцій радикально-ланцюгового і гетерогенно-каталітичного окиснення вуглеводнів та їх похідних.
Олії селективного очищення. Екологічні вимоги до виробництва
Виробництво високоякісних олій. Селективне очищення нафтопродуктів. Критична температура розчинення рафінаду отриманого при очищенні сировини у фенолі. Виробництво бітуму та нафтового коксу, парафинів, мастил та озокерито-церезинової продукції.
Паливо в технологічних процесах
ЗМІСТ Вступ 1. Загальні відомості про паливо 2. Класифікація і властивості палива 3. Переробка твердого палива 4. Переробка нафти 5. Переробка газоподібного палива
Перші страви та бульйони
Реферат Перші страви та бульйони 1. Значення перших страв у харчуванні та їх класифікація 2. Приготування бульйонів 1.Українська народна кухня відрізняється широким вибором перших страв, які готують із різноманітних продуктів. Перші страви збуджують апетит, підвищують секрецію залоз органів травлення.
Джерела забруднення атмосфери 2
Назва реферату : Джерела забруднення атмосфери Розділ : Екологія Джерела забруднення атмосфери Атмосферне повітря забруднюється різними газами, дрібними часточками і рідкими речовинами, які негативно впливають на живі істоти, погіршуючи умови їх існування. Джерела його забруднення можуть бути природними і штучними (антропогенними):
Визначення основних видів забруднення навколишнього середовища
Під забрудненням навколишнього середовища розумітимемо те, що привнесло в екологічну систему не властивих їй живих або неживих компонентів, фізичних або структурних змін, в результаті яких уриваються або порушуються процеси круговороту і обміну речовин, а також відтоки енергії, унаслідок чого знижується продуктивність або руйнується дана екосистема.
Класифікація отруйних речовин
Загальна характеристика хімічних речовин та та шляхи потрапляння їх в організм, гранично допустимі концентрації шкідливих речовин в повітрі, воді та продуктах харчування. Оцінка радіаційної і хімічної обстановки, визначення дози опромінення робітників.
Вивчення конструкції, принципу дії, галузі застосування та способу користування вогнегасником
Конструкція, принцип дії, галузь застосування та користування переносними вогнегасниками. Використання водяних, повітряно-пінних, вуглекислотних, вуглекислотно-брометилових, брометилфреонових, фреонових, аерозольно-хладонових та порошкових вогнегасників.
Короста
РЕФЕРАТ на тему: “К О Р О С Т А” Синоніми: чухачка, сверблячка; лат. – scabies. Заразне паразитарне захворювання, яке викликається коростяним кліщем – sarcoptes scabiei de Leer – внутрішкірним паразитом.
Приготування бульйонів
Рідкою основою багатьох перших страв є бульйони. Бульйон — це відвар з м'яса, кісток, сільськогосподарської птиці, риби з додаванням білого коріння, моркви, цибулі. У бульйон з продуктів переходять екстрактивні речовини, білки, жири, мінеральні та ароматичні речовини.
Любисток лікарський рута пахуча
Волошка синя— Centaurea cyanus Однорічна або дворічна сіро-пухнаста трав'яна рослина. Стебло пряме, гілчасте, заввишки 30—80 см. Листки лан-цетолінійні, нижні — черешкові, верхні — сидячі. Квітки зібрані в суцвіття — кошики на довгих ніжках, крайові квітки лійкоподібні, сині, нерівномірно п'ятизубчасті, а середні — трубчасті, фіолетові, з тичинками і маточкою.
Природній і супутній нафтові гази
РЕФЕРАТ на тему: Природній і супутній нафтові гази Природні і супутні нафтові гази, нафта і кам’яне вугілля – основні джерела вуглеводнів. До недавнього часу ці горючі матеріали використовувалися головним чином як енергоносії.
Уявлення про канцерогенез
Властивості пухлин. Етіологія пухлин. Патогенез. Взаємозв’язок між пухлиною і організмом. Відмінності доброякісних і злоякісних новоутворів. Уявлення про канцерогенез
Дотримання правил хімічної безпеки
Тема: . Загальна характеристика хімічних речовин. Протягом свого життя людина постійно стикається з великою кількістю шкідливих речовин, які можуть викликати різні види захворювань, розлади здоров'я, а також травми як у момент контакту, так і через певний проміжок часу. Особливу увагу становлять хімічні речовини, які залежно від їх практичного використання можна поділити на:
Шкідливі звички тютюнопаління
РЕФЕРАТ НА ТЕМУ: ШКІДЛИВІ ЗВИЧКИ : ТЮТЮНОПАЛІННЯ” підготував учень 11-А класу ЗОШ № 15 ЛОТОЦЬКИЙ ІГОР КОРОТКА ІСТОРІЯ РОЗВИТКУ КУРІННЯ Куріння тютюну має майже 500-річну історію. Відкриття Христофором Колумбом в 1492 році Америки пов’язано з відкриттям європейцями багатьох нових для них рослин, серед яких був і тютюн.
 СН2 Н : С : : С : Н
СН2 Н : С : : С : Н
 C : H
C : H (t0, pt, N) H3C – CH3
(t0, pt, N) H3C – CH3 (t0 , H2SO4) CH3 – CH2 OH
(t0 , H2SO4) CH3 – CH2 OH CH2 – OH
CH2 – OH![]()
![]()
![]()
![]()
![]()
![]() 3С – СН СН2 +HCl HC3 –CHCl –CH3
3С – СН СН2 +HCl HC3 –CHCl –CH3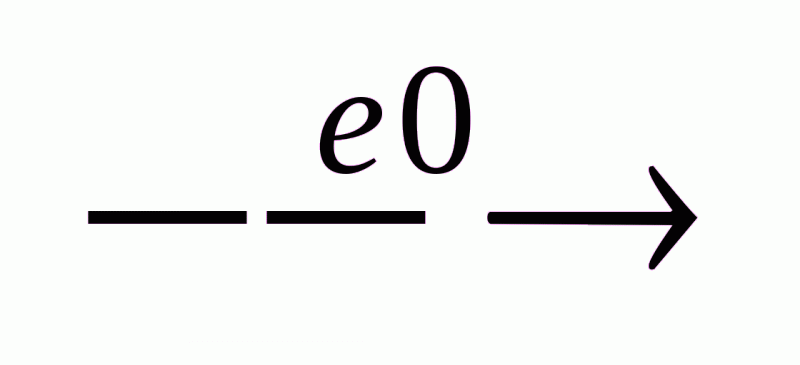 Н СН + Н2
Н СН + Н2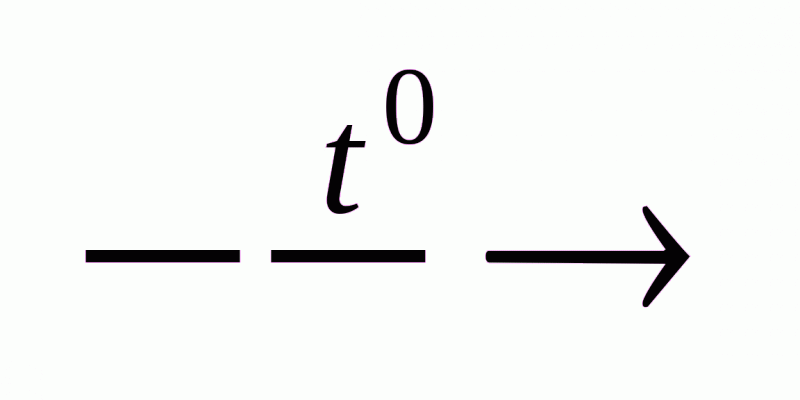 СН2 СН2 + СН3 –СН2 – СН3
СН2 СН2 + СН3 –СН2 – СН3

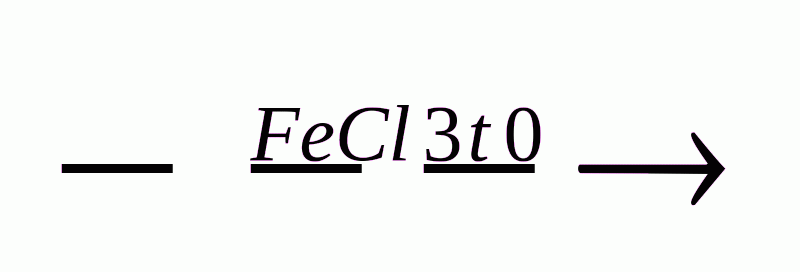 Б-Br +HBr;
Б-Br +HBr;
 (k,H2C) C6H12
(k,H2C) C6H12  3Н2 + Б
3Н2 + Б
