Реакции окисления в промышленном органическоми нефтехимическом синтезе
Окисление органических соединений занимает важное место в промышленном органическом и нефтехимическом синтезе. Окисляют парафиновые углеводороды, нафтены, арены, олефины, диены, спирты, альдегиды, алкины, меркаптаны, амины и др. органические соединения. В качестве окислителей используют O2 , H2 O2 , ROOH, O3 , N2 O, неорганические окислители, включая Cl2 , Br2 , Cl2 O и др.
Процессы окисления по разным признакам можно классифицировать следующим образом:
парциальное окисление;
глубокое окисление (обычно до СО2 и Н2 О);
гомогенное газофазное окисление – обычно радикально-цепное автоокисление или инициированное окисление, процессы горения;
гомогенное гетерофазное (жидкофазное) окисление;
гетерогенно-каталитическое окисление.
Гомогенное жидкофазное окисление делится на радикально-цепное автоокисление (или инициированное окисление) и каталитическое окисление.
Приведем типичные реакции каталитического жидкофазного и гетерогенного окисления органических соединений.
Типичные окислители и реакции
Окисление кислородом
а) Радикально-цепное жидкофазное окисление алкилароматических соединений (катализ комплексами металлов)
![]()
![]()
б) "Мерокс"-процесс
![]()
в) "Вакер"-процесс (окисление олефинов)
![]()
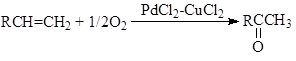
г) Реакция Моисеева (синтез винилацетата)
![]()
д) окислительное карбонилирование метанола
![]()
е) окислительная димеризация
Реакция Глязера-Залькинда:
![]()
Реакция Моритани-Фудживары:
![]()
ж) окислительное хлорирование
![]()
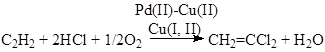
Окисление пероксидом водорода и гидропероксидами
а) Реакция Прилежаева
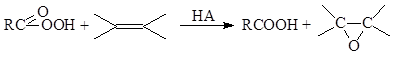
б) Эпоксидирование олефинов
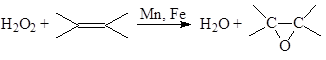
в) Окисление аренов и фенолов
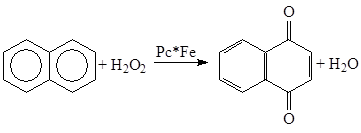
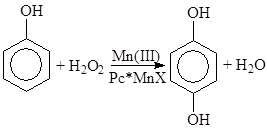
Pc* – замещенные фталоцианины
г) "Халкон"-процесс

Окисление О2 в гетерогенном катализе
а) окисление спиртов
![]()
![]()
б) окисление ароматических соединений
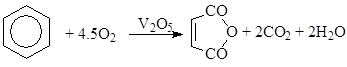

в) окисление алканов (окислительное дегидрирование)
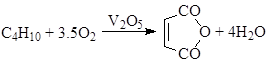
г) окисление олефинов
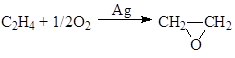
![]()
д) окислительный аммонолиз парафинов и олефинов
![]()
![]()
е) реакция Моисеева в паровой фазе
![]()
ж) синтез аллилацетата
![]()
з) окислительная димеризация метана
![]()
и) окислительное хлорирование этилена
![]()
Появились и новые окислители, например, закись азота N2O. Бензол окисляется этим окислителем на цеолитах ZSM-5, содержащих железо, при 350 – 400оС. Селективность ~100%, конверсия 8 – 13%.
![]()
Недавно (в 2002 г) установлено (Г.И.Панов), что N2O в жидкой фазе без катализатора при давлении 10 атм и температурах 140 – 250оС окисляет олефины до кетонов с селективностью > 98%.
Некоторые процессы, механизмы и кинетические модели
"Вакер"-процесс. Реакция окисления олефинов до карбонильных соединений была открыта практически одновременно в Германии (группа доктора Юргена Смидта в фирме "Consortium für Electrochemie") и И.И.Моисеевым, М.Н.Варгафтиком и Я.К.Сыркиным в СССР (МИТХТ им. М.В.Ломоносова) в 1957 – 1959 гг. Реакция протекает в воде или водно-органических растворах комплексов Pd(II) и Cu(II) при атмосферном давлении и температурах 70 – 95оС, например, синтез ацетальдегида:
![]() (1)
(1)
Реакция (1) вызвала интерес у промышленных фирм, и уже в 1962 году фирма "Wacker Chemie" построила производство альдегида по этой реакции. В промышленных условиях используют давление 10 – 13 атм и температуру 110 – 120о С. Процесс (1) складывается из трех макростадий (2 – 4):
![]() (2)
(2)
![]() (3)
(3)
![]() (4)
(4)
Таким образом, PdCl2 катализирует окисление этилена окислителем CuCl2 (стадии (2) и (3)), а CuCl2 катализирует окисление Pd0 кислородом (стадии 3, 4). Система PdCl2 -CuCl2 является полифункциональным катализатором брутто-процесса (1). Интересно, что молекула воды также катализирует брутто-реакцию и является непременным участником процесса в этой каталитической системе. Поскольку скорость окисления Cu(I) кислородом достаточно велика, стационарность процесса обеспечивается равенством скоростей реакций (2) и (3). В условиях промышленного процесса скорость реакции (3) обеспечивает отсутствие Pd0 в форме металлической фазы, и скорость реакции (1) в определенных пределах не зависит от [CuCl2 ]. Вместо CuCl2 можно использовать другие промежуточные окислители, например, п-бензохинон, концентрация которого при определенном избытке также не влияет на скорость образования ацетальдегида. Эту систему и использовали для построения кинетической модели и изучения механизма реакции. Очевидно, таким образом, что главные события, приводящие к очень интересному превращению этилена с участием H2 O, происходят в реакции (2).
Кинетическое уравнение для реакции (2) в присутствии п-бензохинона (Q) было получено в закрытой системе без газовой фазы (И.И.Моисеев и др.) и по поглощению этилена в двухфазном реакторе полного смешения волюмометрическим методом (П.Генри). В области концентраций PdCl2 до 0.02 М при постоянной ионной силе (I = 1 – 3) в системе NaCl – LiClO4 – HCl – HClO4 = Const Pd(II) находится преимущественно в форме PdCl4 2– , и закомплексованность Pd(II) этиленом не существенна. Скорость реакции (2) или реакции (5)
![]() (5)
(5)
описывается уравнением (6)
![]() (6)
(6)
Из уравнения (6) следует, что процесс протекает с лимитирующей стадией и что в стадиях до лимитирующей выделяются ион Н+ и два иона Cl– при взаимодействии PdCl4 2– и C2 H4 . Для выяснения вопроса о том, из какой частицы выделяется Н+, провели опыты с меченым этиленом (C2 D4 ) в H2 O. Оказалось, что ацетальдегид содержит 4 атома D (CD3 CDO) и, таким образом, Н+ может выделяться только из молекулы H2 O. Схема механизма, соответствующая уравнению (6) и подтвержденная независимым исследованием равновесий в этой системе, включает стадии
![]() (7)
(7)
![]() (8)
(8)
![]() (9)
(9)
![]() (10)
(10)
![]() (11)
(11)
![]() (12)
(12)
![]() (13)
(13)
Механизм лимитирующей стадии (10) и механизм стадии (11) до сих пор являются предметом дискуссий.
Для расчетов промышленного реактора в случае системы PdCl2 -CuCl2 в условиях постоянной концентрации HCl по длине трубчатого реактора (труба в трубе) используют несколько измененное уравнение, найденное экспериментально на основе уравнения (6). Скорость накопления ацетальдегида (САА) или исчезновения этилена вдоль трубы длиной l описывают уравнением
![]() . (14)
. (14)
где d – внутренний диаметр трубы, м; Vсм – объем смеси этилена и раствора, поступающего в трубу, Vсм @ 0.5 м3/сек; [С2 Н4 ]l – концентрация этилена вдоль трубы в молях на м3, рассчитываемая по найденной зависимости [С2Н4]l = f (T, P)
![]() ,
,
где ![]() , rсм – плотность смеси в кг/м3;
, rсм – плотность смеси в кг/м3; ![]() , P0 – общее давление смеси, DP – понижение давления по длине трубы; l – длина трубы.
, P0 – общее давление смеси, DP – понижение давления по длине трубы; l – длина трубы.
Синтез винилацетата (реакция Моисеева). Реакция окислительной этерификации или окислительного ацетоксилирования олефинов
![]() (15)
(15)
была открыта в МИТХТ им. Ломоносова в 1960 г. Реакция осуществляется в растворах солей PdCl2 -CuCl2 и Cu(OAc)2 в уксусной кислоте в присутствии NaOAc. Температура процесса 110 – 130о С и давление 3.0 – 4.0 МПа. Селективность по этилену – 83%. Кинетическое уравнение получено Моисеевым и Беловым в системе, не содержащей CuCl2 (16)
![]() (16)
(16)
в предположении, что в условиях квадратичного торможения ацетатом натрия весь Pd(II) находится в форме комплекса Na2 Pd(OAc)4 . В работе П.Генри приведена другая форма уравнения (16) в предположении, что активной формой Pd(II) является димер Na2 Pd2 (OAc)6 , концентрация которого проходит через максимум по [NaOAc]
![]() (17)
(17)
Процесс синтеза винилацетата по реакции (15) протекает в рамках механизма, аналогичного "Вакер"-процессу. Предполагается превращение p-комплекса Pd(II) в s-палладийорганическое соединение под действием OAc– из раствора, а распад полученного интермедиата включает стадию b-элиминирования ~PdH
![]() , (18)
, (18)
где [Pd] – мономерный или димерный комплекс Pd(II). Окислением H-[Pd] и заканчивается каталитический цикл.
Фирмы Hoechst и др. разработали для реакции (15) гетерогенный катализатор, содержащий соли Pd(II), Au(III) и KOAc на Al2 O3 . Процесс протекает при 175 – 200о С и давлении 0.5 – 1.0 МПа с высокой селективностью: 94% по этилену и 98% по уксусной кислоте. Состояние Pd(II) в условиях процесса и роль соединений золота пока не ясны.
Халкон-процесс. Эпоксидирование олефинов гидропероксидами осуществляется в промышленном варианте в растворах комплексов Mo(VI). В качестве ROOH используют 2-этилфенилгидропероксид (гидропероксид этилбензола, ГПЭБ), гидропероксид кумила (ГПК) и третбутилгидропероксид (ТБГП). В случае ГПЭБ сопряженно с пропиленоксидом получают стирол:
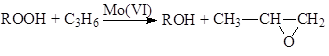 (18)
(18)
![]() (19)
(19)
Скорость реакции (18) описывается уравнением (20)
![]() (20)
(20)
где FMo = 1 + KГПЭБ[ГПЭБ] + KМФК[МФК] + KОП[ОП] + KH2O[H2O] есть закомплексованность катализатора, МФК – метилфенилкарбинол, ОП – пропиленоксид. Ki – константы равновесия образования соответствующих комплексов Mo. Как видно из уравнения (20), процесс протекает с лимитирующей стадией, переходное состояние которой включает ГПЭБ, Mo(VI) и пропилен. Показано, что активным катализатором является пропиленгликолятный комплекс Mo(VI), реакция которого с ГПЭБ и C3H6 приводит к ОП.
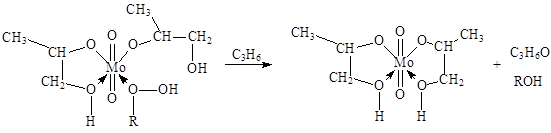
Мерокс-процесс. Реакция окислительной димеризации меркаптанов
![]() (21)
(21)
является основой процесса демеркаптанизации природного газа, попутных газов и нефтяных фракций, разработанного фирмой UOP. В водных растворах комплексов Co(II) (Pc*Co, Pc* – замещенный сульфофталоцианин) в присутствии NaOH происходит процесс образования радикалов RS·, димеризация которых дает RS-SR.
![]()
![]()
![]()
![]()
![]()
Образующиеся Co(III) и H2 O2 также окисляют RSH до RS-SR, и в результате получается реакция (21). Нерастворимый дисульфид отделяется от воды, а водный раствор NaOH с катализатором направляется на экстракцию RSH из газа и нефти.

