Федеральное агентство связи
Сибирский Государственный Университет Телекоммуникаций и Информатики
Межрегиональный центр переподготовки
специалистов
Контрольная
работа
По дисциплине:
Химия
Выполнил:
Шестаков Е. И.
Группа: РДТ -
92
Вариант: 1
Проверил:
___________________
Новосибирск, 2009 г.
Задача 1. Рассчитайте
количество вещества: а) азота массой 14 г.;
б) кислорода массой 48 г.; в) железа массой 112 г.; г) фосфора массой 31 г.
Решение:
Количество вещества
находится по формуле:

а) 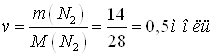 ;
;
б)  ;
;
в)  ;
;
г)  .
.
Ответ: а) 0,5 моль; б)
1,5 моль; в) 2,0 моль; г) 1,0 моль.
Задача 2. Напишите
электронные формулы атомов элементов с порядковыми номерами 9 и 28. Распределите
электроны этих атомов по квантовым ячейкам. К какому электронному семейству
относится каждый из этих элементов?
Решение:
Электронные формулы
атомов:

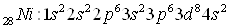
Распределение электронов
по квантовым ячейкам:


Т.к. у фтора происходит
заполнение электронами p –
подуровня, он относится к семейству р – элементов .
Т.к. у никеля происходит
заполнение электронами d – подуровня , он относится к семейству d – элементов .
Задача 3. Вычислить
тепловой эффект реакции восстановления 1 моль
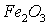 металлическим алюминием.
металлическим алюминием.
Решение:
Уравнение реакции:

Тепловой эффект реакции
равен разности между суммой теплоты образования продуктов реакции и суммой
теплоты образования исходных веществ:
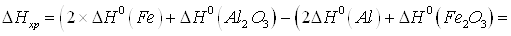

 .
.
Т.е. в результате этой
реакции выделилось 847,7 кДж теплоты при восстановлении 1 моль 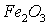 .
.
Ответ:  .
.
Задача 4. Теплоты
образования  оксида
оксида  и оксида
и оксида  азота соответственно равны +90,37
кДж и +33,85 кДж. Определите
азота соответственно равны +90,37
кДж и +33,85 кДж. Определите 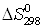 и
и 
для реакций получения NO и 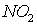 из простых веществ. Можно ли получить эти оксиды при
стандартных условиях? Какой из оксидов образуется при высокой температуре?
Почему?
из простых веществ. Можно ли получить эти оксиды при
стандартных условиях? Какой из оксидов образуется при высокой температуре?
Почему?
Решение:
Уравнение реакций
образования NO и 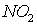 из простых веществ:
из простых веществ:

 .
.
Находим 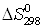 для этих реакций:
для этих реакций:


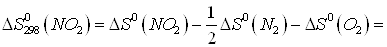

Находим  для этих реакций:
для этих реакций:

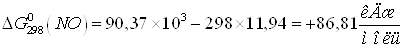

Т.к.  и
и  больше ноля, то при стандартных
условиях эти оксиды получить не возможно.
больше ноля, то при стандартных
условиях эти оксиды получить не возможно.
При высокой температуре
образуется NO, т.к. при увеличении T значение  станет меньше ноля и реакция образования NO станет
возможной.
станет меньше ноля и реакция образования NO станет
возможной.
Ответ:  ;
; 
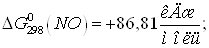
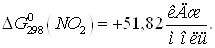
Задача 5. Окисление серы
и её диоксида протекает в уравнениях:
a) 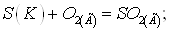 б)
б)  Как изменятся скорости этих реакций,
если объёмы каждой из систем уменьшить в четыре раза.
Как изменятся скорости этих реакций,
если объёмы каждой из систем уменьшить в четыре раза.
Решение:
а) Согласно закону
действия масс скорость прямой реакции до изменения объёма: 
После уменьшения объёма
системы в 4 раза концентрация 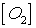 увеличится в 4 раза:
увеличится в 4 раза:  Сера находится в кристаллическом состоянии, поэтому
она на скорость реакции не влияет.
Сера находится в кристаллическом состоянии, поэтому
она на скорость реакции не влияет.
При новой концентрации
скорости прямой реакции равна:
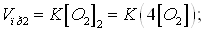
Отсюда: 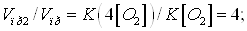
Следовательно, скорость
прямой реакции увеличилась в 4 раза.
б) Согласно закону
действия масс скорости прямой реакции до изменения объёма: 
После уменьшения объёма
гомогенной системы в 4 раза концентрация каждого из реагирующих веществ
увеличится в 4 раза:


При новых концентрациях
скорость прямой реакции равна:

Отсюда:  .
.
Следовательно, скорость
прямой реакции увеличилась в 64 раза.
Ответ: а) скорость прямой
реакции увеличилась в 4 раза.
б) скорость прямой
реакции увеличилась в 64 раза.
Задача 6. Вычислите
молярную и эквивалентную концентрации 20% - ог раствора хлорида кальция,
плотность которого 1,178 г/см3.
Решение:
Возьмём раствор объёмом
V=1 литр = 1000 см3.
 =
= .
.
Т.к.  это соль двухвалентного металла и одноосновной
кислоты, то
это соль двухвалентного металла и одноосновной
кислоты, то 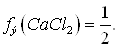

Ответ: 2,1М; 4,2н.
Задача 7. Вычислите
процентную концентрацию водного раствора сахара  , зная температуру кристаллизации раствора
, зная температуру кристаллизации раствора  . Криоскопическая константа воды 1,86 град.
. Криоскопическая константа воды 1,86 град.
Решение:
Температура
кристаллизации чистой воды  , следовательно,
, следовательно,
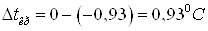 .
.
Зная, что молярная масса
сахара 342г/моль, находим массу m (г) растворенного вещества, приходящуюся на 1000 г ( 1 кг ) воды из уравнения:

Откуда: 
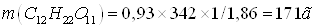 .
.
Общая масса раствора: m (
раствора ) = = .
.
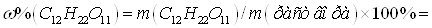
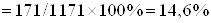 .
.
Ответ: 14,6%.
Задача 8. Реакции
выражаются схемами:
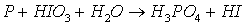

7. Составьте электронные
уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции
укажите, какое вещество является окислителем, какое – восстановителем; какое
вещество окисляется, какое – восстанавливается.
Решение:
1) 
Электронные уравнения:

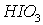 - окислитель, восстанавливается; Р – восстановитель,
окисляется.
- окислитель, восстанавливается; Р – восстановитель,
окисляется.
2)  ;
;
Электронные уравнения:

 - окислитель, восстанавливается;
- окислитель, восстанавливается; 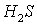 - восстановитель, окисляется.
- восстановитель, окисляется.
Другие работы по теме:
Кейнсианская теория
Основополагающее Кейнсианское уравнение. Монетарная трактовка Кейнсианского уравнения.
по Химии
Стехиометрические понятия и правила: Массовая доля вещества, молярная концентрация вещества Фактор эквивалентности, химический эквивалент Молярная масса эквивалента, количество вещества эквивалента
Билеты по химии
и частичные ответы на некоторые из них Билет №1 Простые вещества . Количество вещества. Число Авогадро. Качественный анализ анионов и катионов. Билет №2
Закон сохранения массы и энергии
Закон сохранения массы как важнейшее открытие атомно-молекулярной теории. Особенности изменения массы в химических реакциях. Определение молярной массы вещества. Составление уравнения реакции горения фосфора. Решение задач на "избыток" и "недостаток".
Химическая кинетика
Основные понятия и законы химической кинетики. Кинетическая классификация простых гомогенных химических реакций. Способы определения порядка реакции. Влияние температуры на скорость химических реакций. Сущность процесса катализа, сферы его использования.
Билеты по химии
и частичные ответы на некоторые из них Билет №1 Простые вещества . Количество вещества. Число Авогадро. Качественный анализ анионов и катионов. Билет №2
Шпоры по химии
(В)=m (В) M Ф.Е. (В)=М(В)/Z(B) Закон Авогадро Закон эквивалентов (А)/М (В)=(М(А)/z )/(M(B)/z Концентрация 1.Массовая доля w=m 2.Молярная концентрация С
Влияние температуры на скорость химических реакций
5 5.1 Уравнение Аррениуса Скорость химической реакции зависит не только от концентрации, но и от температуры. Как показывает опыт, скорость большинства реакций увеличивается при повышении температуры в 2 ч 4 раза на каждые 10 градусов.
Закон сохранения массы и энергии
Закон сохранения массы и энергии После доказательства существования атомов и молекул важнейшим открытием атомно-молекулярной теории стал закон сохранения массы, который был сформулирован в виде философской концепции великим русским ученым Михаилом Васильевичем Ломоносовым (1711-1765) в 1748 г. и подтвержден экспериментально им самим в 1756 г. и независимо от него французским химиком А.Л.Лавуазье в 1789 г.
Эпюра внутренних сил
Задача №1 а = 0,5 м q = 10 kH/м F = 2,5 cм2 Е = 2105 Мпа L -?, N -?, -? Решение. Данная задача является статически неопределимой, так как её нельзя решить при помощи только уравнений статики (уравнений равновесия). Недостающее уравнение составим из условия деформаций. Для этого отбросим одну из заделок (правую) и заменим её действие неизвестной реактивной силой
Эпюра внутренних сил
Построение эпюры внутренних сил на основании данных о реакции заделок и действующих нагрузках. Скачки напряжения из-за резкого изменения площади в местах изменения поперечного сечения. Направление реакции левой и правой заделки, уравнение равновесия.
Уравнение состояния
Уравнение состояние Статистика атмосферы и простейшее приложение Уравнение №1 и №2 в метеорологии и их нужно знать наизусть. Лекция 2.1 Уравнение состояние воздуха и его приложение.
Доказательство теоремы Ферма для n=4
Формулирование и доказательство великой теоремы Ферма методами элементарной алгебры с использованием метода замены переменных для показателя степени n=4. Необходимые условия решения уравнения. Отсутствие решения теоремы в целых положительных числах.
Доказательство теоремы Ферма для n=3
Доказательство великой теоремы Ферма для n=3 методами элементарной алгебры с использованием метода решения параметрических уравнений. Диофантово уравнение, решение в целых числах, отсутствие решения в целых положительных числах при показателе степени n=3.
Доказательство теоремы Ферма для n 3
Доказательство великой теоремы Ферма для показателя степени n=3 Великая теорема Ферма формулируется следующим образом: диофантово уравнение: Аn+ Вn = Сn (1)
Полиномы
--------------------------------------------------------------------------¬ ¦ Корень n-й степени и его свойства. ¦ ¦Пример 1. ¦ ¦ Решим неравенство х6>20 ¦
Доказательство теоремы Ферма для n 4
Доказательство великой теоремы Ферма для показателя степени n=4 Великая теорема Ферма формулируется следующим образом: диофантово уравнение: Аn+ Вn = Сn (1)
Площадь треугольника
Методика нахождения уравнения прямой исследуемого треугольника и параллельной ей стороне с использованием углового коэффициента. Определение уравнения высоты этого треугольника. Порядок и составление алгоритма вычисления площади данного треугольника.
Краткое доказательство гипотезы Билля
Формулировка гипотезы Билля и методика ее краткого доказательства. Анализ составляющих гипотезу алгебраических выражений. Использование метода замены переменных при доказательстве гипотезы Билля, не имеющей решения при целых положительных числах.
Алгебраическое доказательство теоремы Пифагора
Доказательство теоремы Пифагора методами элементарной алгебры: методом решения параметрических уравнений в сочетании с методом замены переменных. Существование бесконечного количества троек пифагоровых чисел и, соответственно, прямоугольных треугольников.
Площадь треугольника
Задача Дано: треугольник с вершинами в точках А [4; 0] B [3; 20] и C [5; 0]. Найти: Уравнение прямой АВ; Уравнение высоты СD, проведенной к стороне АВ; Уравнение прямой СЕ, параллельной стороне АВ;
Краткое доказательство гипотезы Билля
Гипотеза Билля формулируется следующим образом: неопределенное уравнение: не имеет решения в целых положительных числах А, В, С, при условии, что больше 2.
Катализаторы и ферменты
Катализатором, или ферментом (в случае биохимической реакции), называется вещество, помогающее протеканию химической реакции, но не изменяющееся в ходе нее.

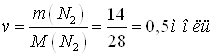 ;
;  ;
;  ;
; .
.![]()
![]()


![]() металлическим алюминием.
металлическим алюминием.![]()
![]()
![]()
![]() .
.![]() .
. ![]() .
.![]() оксида
оксида ![]() и оксида
и оксида ![]() азота соответственно равны +90,37
кДж и +33,85 кДж. Определите
азота соответственно равны +90,37
кДж и +33,85 кДж. Определите ![]() и
и ![]()
![]() из простых веществ. Можно ли получить эти оксиды при
стандартных условиях? Какой из оксидов образуется при высокой температуре?
Почему?
из простых веществ. Можно ли получить эти оксиды при
стандартных условиях? Какой из оксидов образуется при высокой температуре?
Почему? ![]() из простых веществ:
из простых веществ: ![]()
![]() .
.![]() для этих реакций:
для этих реакций:![]()
![]()
![]()
![]()
![]() для этих реакций:
для этих реакций:![]()
![]()
![]()
![]() и
и ![]() больше ноля, то при стандартных
условиях эти оксиды получить не возможно.
больше ноля, то при стандартных
условиях эти оксиды получить не возможно.![]() станет меньше ноля и реакция образования NO станет
возможной.
станет меньше ноля и реакция образования NO станет
возможной.![]() ;
; ![]()
![]()
![]()
![]() б)
б) ![]() Как изменятся скорости этих реакций,
если объёмы каждой из систем уменьшить в четыре раза.
Как изменятся скорости этих реакций,
если объёмы каждой из систем уменьшить в четыре раза.![]()
![]() увеличится в 4 раза:
увеличится в 4 раза: ![]() Сера находится в кристаллическом состоянии, поэтому
она на скорость реакции не влияет.
Сера находится в кристаллическом состоянии, поэтому
она на скорость реакции не влияет.![]()
![]()
![]()
![]()
![]()
![]()
![]() .
.![]() =
=![]() .
.![]() это соль двухвалентного металла и одноосновной
кислоты, то
это соль двухвалентного металла и одноосновной
кислоты, то ![]()
![]()
![]() , зная температуру кристаллизации раствора
, зная температуру кристаллизации раствора ![]() . Криоскопическая константа воды 1,86 град.
. Криоскопическая константа воды 1,86 град.![]() , следовательно,
, следовательно, ![]() .
. ![]()
![]()
![]() .
.![]() .
.![]()
![]() .
.![]()
![]()
![]()

![]() - окислитель, восстанавливается; Р – восстановитель,
окисляется.
- окислитель, восстанавливается; Р – восстановитель,
окисляется.![]() ;
;
![]() - окислитель, восстанавливается;
- окислитель, восстанавливается; ![]() - восстановитель, окисляется.
- восстановитель, окисляется.
