Александр Александрович Болдырев, доктор биологических наук
Человек давно предполагал наличие взаимодействий между иммунной и нервной системами в организме. Недаром нам всем привычна пословица “В здоровом теле - здоровый дух”. Известны также и примеры обратной связи - еще Гиппократ отметил эту закономерность. В его “Диалогах” ученики спрашивают: “Учитель, ты лечил богатых и бедных, победителей и побежденных. Какова разница между ними?” И Гиппократ ответил: “Раны победителей заживают быстрее!”
И вот совсем недавно нейрохимики получили доказательства реальной связи между иммунной и нервной системами. В лимфоцитах, циркулирующих в кровяном русле, обнаружены специфические рецепторы нервных клеток. Изучение свойств этих рецепторов открывает новые возможности взаимодействия двух важнейших систем организма.
Глутаматные рецепторы в нервной системе
Среди различных медиаторов, обеспечивающих передачу возбуждения между нейрональными клетками, особое место занимает достаточно простая по структуре молекула глутаминовой кислоты, глутамат: HOOC–СН2–СН2–СН(NH2)–СООН. Глутаматергические механизмы представлены примерно в 40% нервных клеток, а оставшаяся часть выпадает на долю всех остальных медиаторов (серотонина, ацетилхолина, допамина и др.).
По своему участию в работе нервных клеток глутаматные рецепторы делятся на два больших подтипа. Одни, ионотропные, соединены с ионными каналами, они открывают их после активации соответствующими молекулами (лигандами), так что потоки ионов вызывают электрическую активность нейрона. Другие, метаботропные, структурно не связаны с ионными каналами, они управляют метаболическими процессами в клетке через специальные сигнальные молекулы-информаторы, контролируя активность ионотропных рецепторов. Лиганды, активирующие нейрональные рецепторы, - их первичные информаторы (первичные мессенджеры), а сигнальные молекулы, образующиеся при активации метаботропных рецепторов и использующиеся для корректировки сигналов внутри клетки, - вторичные мессенджеры.
Наличие разных глутаматных рецепторов в глутаматергических синапсах головного мозга продемонстрировано с помощью фармакологических соединений, взаимодействующих с каким-либо одним видом глутаматных рецепторов. Выделяют три группы ионотропных рецепторов, названных в соответствии с лигандами, обеспечивающими их активацию: NMDA-рецепторы, каинатные рецепторы и AMPA-рецепторы.
Метаботропные рецепторы в настоящее время представлены восемью различными белками, которые делятся на три группы в зависимости от того, какие вторичные мессенджеры они включают в работу. Рецепторы группы I связаны с регуляцией кальций-зависимых реакций, а II и III групп - с циклическими нуклеотидами.
Более подробно о функциях вторичных мессенджеров в клетках и внутриклеточных путях регуляции можно прочитать в специальной литературе [1].
Кроме соединений, имитирующих действие глутамата на отдельные виды рецепторов, агонистов глутамата, известны и вещества, избирательно выключающие их, - антагонисты глутамата. Для простоты изложения не будем приводить полные названия, а ограничимся общеупотребимыми сокращениями этих синтетических лигандов, которые активно используют в экспериментальной нейрохимии. Однако следует обратить внимание, что все разнообразие возможностей современной фармакологии вместилось в одну простую формулу глутамата, способного в синаптических структурах мозга активировать различные рецепторы, причем в том соотношении, которое обеспечивает согласованную работу всей глутаматергической системы.
Молекулярные реакции активируемого нейрона
Нейрон активируется в результате взаимодействия глутамата с ионотропными рецепторами. Возникающая при этом электрическая активность (электрический потенциал) распространяется вдоль по аксонам до нервного окончания и передает информацию о возбуждении на другие нейроны. Одновременно в возбуждаемой нервной клетке происходят важные метаболические изменения. Временная последовательность этих процессов в общих чертах выяснена и представляется следующим образом. При высвобождении глутамата в межсинаптическую щель среди всех рецепторов, взаимодействующих с ним, наиболее активны каинатные. Они открывают соответствующие ионные каналы, через которые ионы натрия устремляются внутрь клетки и формируют возбуждающий потенциал. Аналогичную роль выполняют AMPA-рецепторы.
В покоящемся нейроне NMDA-рецепторы связаны с ионами магния, из-за чего их сродство к медиатору снижено. Однако благодаря деполяризации мембраны, вызываемой возбуждающим потенциалом, комплекс распадается, ионы магния отделяются от NMDA-рецепторов, и способность последних связывать глутамат повышается. Таким образом, на второй стадии возбуждения открываются NMDA-зависимые ионные каналы, пропускающие внутрь нейрона натрий и кальций. Это удлиняет возбужденное состояние мембраны и одновременно включает внутриклеточные реакции, зависящие от ионов кальция.
Длительность второй волны возбуждения определяется не только активностью NMDA-рецепторов. Появление глутамата в межсинаптической щели стимулирует специальные белки, которые обеспечивают захват и обратный транспорт этого медиатора в нервные или глиальные клетки. Точно так же и ионы кальция, попавшие внутрь возбужденного нейрона, с одной стороны, инициируют высвобождение дополнительного количества кальция из внутриклеточных депо, а с другой, - активируют ионные насосы, выбрасывающие кальций из клетки наружу. Следовательно, вероятность активации NMDA-рецепторов лежит в том временном интервале, когда они еще могут связаться с медиатором (мембрана нейрона деполяризована и магний отделен от ингибирующего центра), а в межсинаптической области еще имеются молекулы глутамата, избежавшие обратного захвата. Но и кальций-зависимые реакции в клетке имеют ограниченные временные возможности - пока стационарная (очень низкая) концентрация этого иона не будет восстановлена. Таким образом, взаимодействие между каинатными и NMDA-рецепторами определяет длительность волны возбуждения и эффективность перестройки метаболизма нервной клетки под влиянием кальция.
Но даже и эта сложная игра на сродстве разных рецепторов к глутамату и эффективности системы его обратного транспорта не исчерпывает тонкой настройки нервной клетки на передачу и реализацию возбуждения. Она довершается участием метаботропных рецепторов в регуляции активности ионотропных рецепторов и глутаматного транспортера.
На пресинаптической мембране при возбуждении метаботропные рецепторы групп II и III подавляют высвобождение глутамата. Напротив, метаботропные рецепторы группы I стимулируют этот процесс. Их действие инициируют арахидоновая кислота (АА) и диацилглицерин (DAG), которые высвобождаются при активации фосфолипазы С (PLC) метаботропными рецепторами группы I на постсинаптической мембране. Второй регулятор, диацилглицерин, активирует протеинкиназу С, которая блокирует калиевые каналы. На этой же постсинаптической мембране метаботропные рецепторы групп II и III блокируют потенциал-зависимые Са-каналы. Таким образом, возбуждение клетки, вызванное ионотропными рецепторами синаптического контакта, контролируется метаботропными рецепторами этих же синаптических мембран (рис.1).
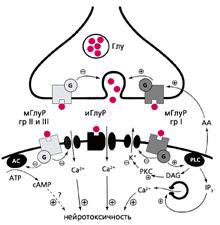
Рис.1. Схема взаимодействия ионотропных и метаботропных рецепторов в функции нейрона.
Глутамат высвобождается из пресинаптического окончания и взаимодействует с ионотропными (иГлуР) и метаботропными (мГлуР) рецепторами (I, II и III) в зависимости от того, с какими вторичными мессенджерами они связаны - инозитолтрифосфатом, (IP3), циклическим АМФ, (сАМР), ионами кальция и ферментом аденилатциклазой (АС). Эти мессенджеры активируют различные внутриклеточные киназы (в том числе протеинкиназу С, РKС), регулирующие проницаемость ионных каналов постсинаптической мембраны. Избыточная продукция вторичных мессенджеров приводит к нейротоксичности. Метаботропные рецепторы группы I увеличивают высвобождение глутамата, а групп II и III - уменьшают его.
Активация протеинкиназы С и подавление K-каналов удерживают деполяризацию мембраны, тем самым препятствуя связыванию магния с NMDA-рецепторами и поддерживая их сродство к медиатору. Вероятно, именно благодаря этому избыточное возбуждение метаботропных рецепторов вызывает токсический эффект NMDA. Это свойство лежит в основе дисбаланса в функции нервных клеток, который проявляется при различных повреждениях мозга - от нейродегенерации до ишемии, наступающей при инсульте. Значит, нейротоксичность NMDA-рецепторов может приводить к клеточной смерти - либо к некрозу, либо к апоптозу.
Для понимания молекулярных механизмов работы системы небезразлично, какой путь будет выбран. Важно это знать и медикам, разрабатывающим способы защиты нейронов мозга от смерти в неблагоприятных условиях [2]. Современные приборы с помощью специальных красителей позволяют количественно оценить каждый из этих видов клеточной смерти при окислительном повреждении мозга. Очень часто для таких исследований используется проточная цитометрия - метод индивидуальной характеристики клеток [3].
Апоптоз, некроз и пролиферация клеток
Благодаря проточной цитометрии исследователи могут легко отличать живые нейроны от тех, которые встали на путь клеточной смерти, и дифференцировать некротические нейроны от апоптозных на самых ранних стадиях. Апоптоз - генетически запрограммированная смерть, осуществляемая с помощью специфических механизмов и ферментов. При апоптозе клетка сморщивается, ее структуры разрушаются цистеиновыми-аспарагиновыми протеиназами, так называемыми каспазами. Семейство этих ферментов (в него входит около десяти различных протеиназ) составляет каскад взаимоконтролируемых белков, перевод которых в активное состояние требует одновременного присутствия ряда клеточных факторов. Такой ступенчатый механизм предохраняет от случайного возникновения апоптоза.
Некроз обусловлен механическим или иным повреждением клеточной мембраны, нарушением целостности и управляемости клетки. Клетки, не способные выполнять свои функции, умирают, а их большое количество создает в ткани очаг воспаления.
Несмотря на принципиальные отличия апоптоза и некроза, их объединяет полезное свойство - они помогают организму очиститься от ненужных (поврежденных) или вредных (чужеродных) структур. В очаг воспаления устремляются макрофаги и другие клетки, “мусорщики”, удаляющие некротические части тканей или чужеродные частицы (например, попавшие в ткани занозы). С помощью апоптоза организм пытается распознать и ликвидировать клетки-мутанты, ставшие опасными для организма (перерождающиеся спонтанно или под влиянием внешних факторов). Так, частота появления в организме злокачественных клеток много выше, чем вероятность самого заболевания, поскольку в большинстве случаев они распознаются и нейтрализуются иммунной системой без вреда для организма.
Апоптоз запрограммирован на постепенное контролируемое устранение клеток, а некроз осуществляется быстро, хаотически и неуправляемо. При апоптозе фрагменты клеток или даже целые белковые молекулы могут использоваться другими клетками для выполнения тех же самых функций. Например, в тимусе, где происходит созревание лимфоцитов, клетки, распадающиеся при апоптозе, поставляют свои белки-рецепторы для превращения “юных” лимфоцитов в полноценные иммунные клетки.
Эпителиальные клетки слизистой запрограммированы таким образом, что апоптоз индуцируется в них периодически и с большой частотой (они живут лишь 1.5-2 недели). Отторжение апоптозных клеток снижает вероятность проникновения в организм вирусной инфекции. Интересно, что в русской армии для предотвращения кишечных эпидемий по указу Петра I в пищу добавляли перец. Сегодня известно, что это прекрасное средство для активации апоптоза клеток слизистого эпителия.
Так или иначе, выгода распознавания ранних стадий и типа клеточной смерти очевидна. Для каждого из них имеются свои специфические маркеры. Один из фосфолипидов клеточных мембран, фосфатидилсерин, в нормальных условиях расположенный с внутренней стороны мембранного бислоя, при нарушениях цитоскелета сигнализирует о начале апоптоза. Кстати, именно так макрофаги распознают и удаляют злокачественные клетки. Белки, чувствительные к фосфатидилсерину (аннексины), используют для раннего распознавания апоптозных клеток. А для некротических клеток с поврежденной мембраной имеется другой маркер. Им может быть краситель, например иодид пропидия (PI), который связывается с нуклеиновыми кислотами, но не проникает через мембрану живых (нативных) клеток.
Экспериментально показано, что после длительной (30 мин) индукции окислительного стресса активацией NMDA-рецепторов появляются и некротические, и апоптозные клетки, причем их долю в популяции легко рассчитать (рис. 2). Таким образом, в руках исследователей имеется модель, позволяющая оценивать как потенциальную уязвимость нейронов со стороны различных факторов, так и возможность защиты клеток от апоптоза или некроза (например, с помощью лекарственных препаратов).
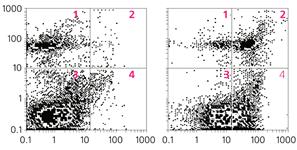
Рис.2. Экспериментальные результаты индукции апоптоза и некроза в суспензии нейронов: в контроле (слева) и после 30 мин инкубации в присутствии 0.5 мМ NMDA (справа). Цифрами указаны субпопуляции нейрональных клеток: живые (3), апоптозные (4), подверженные легкому (1) и тяжелому (2) некрозу.
Следить за развитием апоптоза можно также, измеряя активность внутриклеточных каспаз, которые в клетке взаимно контролируют друг друга (рис. 3). Так, при связывании на клеточной мембране внеклеточных сигнальных молекул со специальным рецептором (CD95/Fas) в цитоплазме неактивная прокаспаза 8 превращается в активный фермент, который, в свою очередь, активирует каспазу 3, что открывает клетке путь к апоптозу. Нагружая клетки флуорогенным субстратом каспазы 3 и стимулируя их разными способами, можно измерять сигнал от флуоресцентного продукта. Растет продукт - активируется каспаза 3, и интенсивность сигнала будет пропорциональна активации фермента и вероятности развития апоптоза.
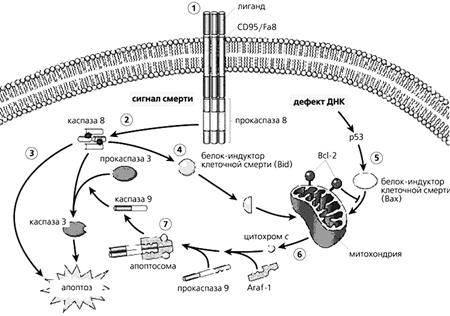
Рис.3. Схема активации апоптоза, вызванной лигандом, взаимодействующим с рецептором CD95/Fas и стимулирующим каспазный цикл.
1 - взаимодействие лиганда с клеточным рецептором;
2 - высвобождение прокаспазы 8 и ее активация (сигнал клеточной смерти);
3 - появление одного из факторов активации апоптоза (активная каспаза 8);
4, 5 - образование белков клеточной смерти (Bid, Bax), устраняющих защиту митохондриальной мембраны белком Bcl-2, препятствующим утечке цитохрома с;
6 - утечка цитохрома с из митохондрий и образование апоптосом с участием фактора Apaf-1;
7 - образование апоптосом и превращение прокаспазы 9 в активный фермент, активирующий каспазу 3, которая инициирует апоптоз.
Однако каспаза 3 участвует не только в реализации апоптоза, но и во многих стадиях клеточного цикла и в процессах пролиферации [4]. Особенно важны эти реакции для клеток иммунной системы. Значит, в ряде случаев активность каспазы 3 не обязательно означает начало апоптоза, а может быть связана с пролиферацией лимфоцитов.
Глутаматные рецепторы иммуннокомпетентных клеток
История открытия и изучения глутаматных рецепторов накопила массу примеров их причастности к работе нервной системы: NMDA-рецепторы ответственны за молекулярные механизмы памяти, метаботропные рецепторы вовлечены в процессы нейропластичности [5]. Тем неожиданнее оказались факты, указывающие на возможное присутствие глутаматных рецепторов не только в нейрональных клетках [6]. В 1997 г. И.А.Костанян и соавторы обнаружили, что глутамат хорошо связывается с мембранами лимфоцитов человека [7]. Вытеснить из этой связи его можно, добавляя структурный аналог глутамата - квисквалоновую кислоту. Позже было показано, что глутаматные рецепторы имеются в лимфоцитах грызунов, и их активация приводит к росту в клетках свободных ионов кальция и активных форм кислорода, в результате чего активируется каспаза 3 [8]. Предотвращение роста активного кислорода блокирует этот фермент (рис.4). Все эти факты демонстрировали, что работа NMDA-рецепторов в лимфоцитах - не случайный процесс, а связана с глутаматной регуляцией иммуннокомпетентной системы клетки.
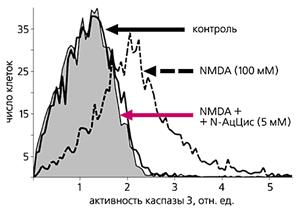
Рис.4. Экспериментальные кривые активации каспазы 3.
Инкубация лимфоцитов мыши с N-метил-D-аспартатом (NMDA) приводит к увеличению каспазной активности. Антиоксидант N-ацетилцистеин препятствует активации каспазы.
Дальнейшие исследования, проводимые в МГУ им.М.В.Ломоносова и в Институте неврологии РАМН, показали, что, кроме NMDA-рецепторов, в лимфоцитарной мембране имеются и метаботропные рецепторы группы III. Как и в нейрональных клетках, они выступают регуляторами ионотропных рецепторов. В наших экспериментах при активации NMDA-рецепторов в лимфоцитах увеличивалась концентрация ионов кальция и активных форм кислорода и, как следствие, активировалась каспаза 3. Ни один из этих эффектов не проявлялся, если в среду инкубации добавляли активатор метаботропных рецепторов L-AP4. Однако совместное присутствие NMDA и L-AP4 оказывало драматический эффект на жизнеспособность клеточной популяции. Даже после короткой инкубации появлялось большое количество мертвых клеток. Это привело нас к выводу, что присутствие ионотропных и метаботропных рецепторов глутамата на мембранах лимфоцитов делает их чувствительными к тем же самым сигнальным молекулам, которые управляют активностью нейронов (рис.5).
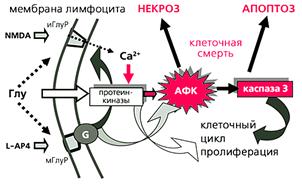
Рис.5. Регуляция жизни и смерти лимфоцита глутаматными рецепторами.
При взаимодействии глутамата (Глу) с ионотропными рецепторами (иГлуР) ионы кальция входят внутрь клетки, активизируют протеинкиназы и каспазу 3, которая стимулирует пролиферацию. Взаимодействие глутамата с метаботропными рецепторами (мГлуР) через G-белки стимулирует активность иГлуР, что приводит к дополнительной активации протеинкиназ и усиленному росту активных форм кислорода (АФК). В этом случае возможна индукция клеточной смерти как по пути апоптоза, так и по пути некроза. NMDA и L-AP4 имитируют раздельный эффект глутамата на иГлуР и мГлуР соответственно.
* * *
Насколько важен факт распространения глутаматных механизмов регуляции на иммунную систему? Фактически, открытие на клетках иммунной системы глутаматных рецепторов, ответственных за молекулярную память, позволяет предполагать общность формирования поведенческих, адаптационных и других реакций в клетках нервной и иммунной систем. Другими словами, и те и другие клетки открыты одним и тем же видам сигнальных молекул, и информация, обусловленная их появлением, доступна как нервной, так и иммунной системе. Значит, эти системы могут “общаться”, используя язык одних и тех же химических символов [9]. Наличие глутаматных рецепторов в клетках иммунной системы вскрывает структурную основу этих взаимодействий и позволяет считать глутамат не только нейро-, но и иммунномедиатором.
Список литературы
1. Введение в молекулярную медицину / Ред. М.А.Пальцев. М., 2004.
2. Болдырев А.А. // Биохимия. 2000. Т.65. С.981-990.
3. Болдырев А.А., Юнева М.О. // Соросовский образовательный ж-л. 2004. Т.8 (№2). С.7-14.
4. Caspases: their role in cell death and cell survival / Eds M.Los, H.Waczak. 2002.
5. Carpenter D. NMDA receptors and the molecular mechanisms of excitotoxicity, in Oxidative Stress at Molecular, Cellular and Organ Levels / Еds P.Johnson, A.Boldyrev. Research Signpost, Trivandrum, 2002. P.77-88.
6. Болдырев А.А., Тунева Е.О. // Биол. мембраны. 2005. Т.22. С.142-145.
7. Костанян И.А., Наволоцкая Е.В., Нуриева Р.И. и др. // Биоорг. хим. 1997. Т.23. С.805-808.
8. Boldyrev A.A., Kazey V.I., Leinsoo T.A. et al. // Biochem. Biophys. Res. Commun. 2004. V.324. P.133-139.
9. Nedergaard M., Takano T. and Hansen A.J. // Nature Rev. Neurosci. 2002. V.3. P.748-755.

