Київський національний університет імені Тараса Шевченка
Геологічний факультет
Кафедра мінералогії, геохімії, та петрографії
РЕФЕРАТ
на тему:
Потрійні системи
(MgO – SiO2 – H2O)
Виконала
Беспалова Л.А.
Перевірив
Остапенко Г.Т.
Київ - 2004
MgO – SiO2 – H2O. Побудова потрійних діаграм систем, що містять воду, вимагає особливого підходу, так як разом із відображенням зміни температури і складу виникає необхідність показати зміну тиску води. Склад компонентів і мінералів можна нанести звичайним способом на трикутну сітку, на якій H2O показана одним із компонентів. Співіснування різних фаз всередині системи зображується за допомогою лінії Алькемаде. Варто відмітити, що в подібних випадках існують лінії рівноважних співвідношень між твердими фазами і паром або флюїдом, що представляє собою майже чисту H2O. Рівноважні відношення можуть охоплювати як вузьку, так і широку область температур і тисків. Тому на практиці звичайно на трикутній діаграмі складу показують розташування рівноважних фаз, а параметри температури і тиску, до яких воно прикладається, або дають у вигляді графіка тиск – температура, або просто позначають цифрами.
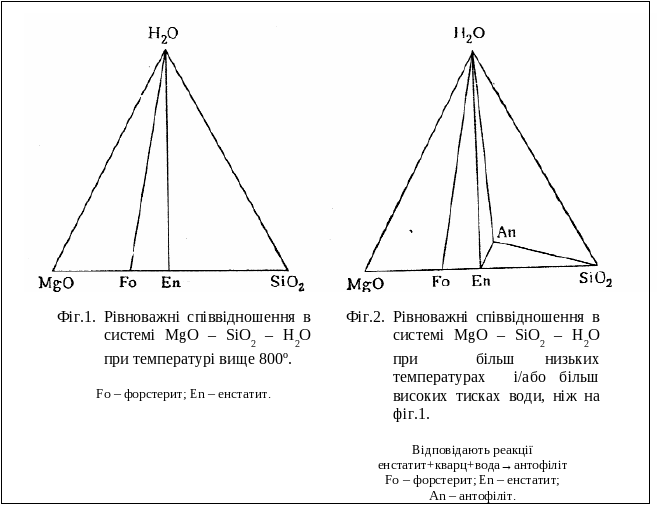

На фіг.1. стабільні взаємовідношення в системі MgO – SiO2 – H2O при низькому тиску води і температурах, що перевищують 800єС, показані у вигляді трикутників співіснуючих фаз. Присутні тут чотири тверді фази – периклаз, форстерит, енстатит і кварц – нанесені на основу MgO - SiO2 трикутника складу. Лінії, які сполучають, показують, що кожна з цих фаз може існувати в присутності водяної пари, не утворюючи з ним гідратних сполук. При пониженні температури суміш енстатиту і кварцу буде реагувати з парою води, утворюючи антофіліт (фіг.2):
енстатит + кварц + водяна пара → антофіліт
І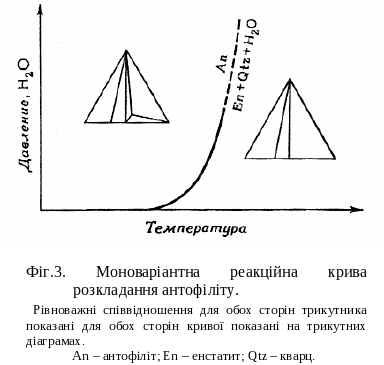 снування чотирьох фаз в трикомпонентній системі говорить про наявність моноваріантність умов (так як P + F = C + 2, 4 + F = 3+2, F = 1). Ця моноваріантна реакція являється функцією тиску і температури і може бути представлена у вигляді моноваріантної лінії (фіг.3). Стабільні співвідношення фаз з кожної сторони від лінії зображуються графічно у вигляді відповідних рівноважних трикутників.
снування чотирьох фаз в трикомпонентній системі говорить про наявність моноваріантність умов (так як P + F = C + 2, 4 + F = 3+2, F = 1). Ця моноваріантна реакція являється функцією тиску і температури і може бути представлена у вигляді моноваріантної лінії (фіг.3). Стабільні співвідношення фаз з кожної сторони від лінії зображуються графічно у вигляді відповідних рівноважних трикутників.
При подальшому пониженні температури стійким стає тальк (фіг.4), що призводить до інших асоціацій рівноважних фаз. Має місце наступна реакція:
антофіліт + кварц + пара = тальк
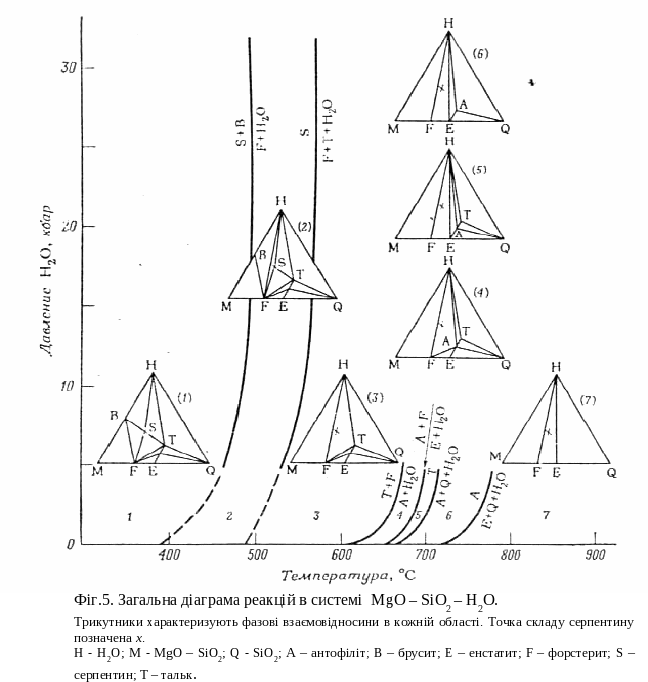
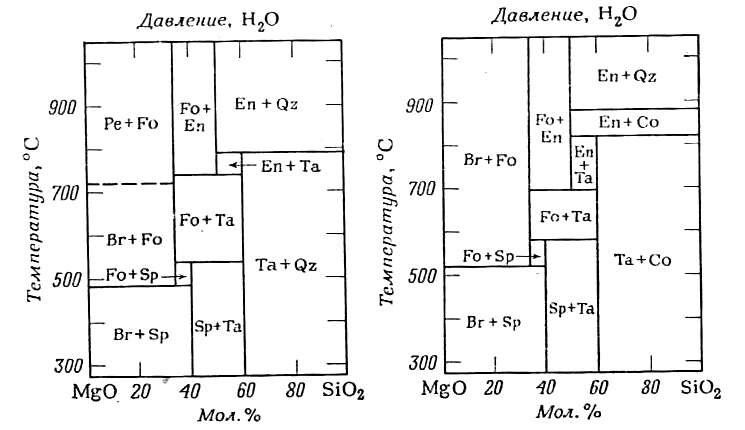
Повні свідчення про цю систему приведені на фіг.5, де в тих же координатах тиск – температура показані всі відомі сполучні лінії і моноваріантні криві. Ця фігура представляє собою сукупність всіх моноваріантних реакцій. однією з яких є реакція, що зображена на фіг.3. Області між моноваріантними кривими характеризуються визначеними рівноважними асоціаціями, що показані невеликими трикутниками с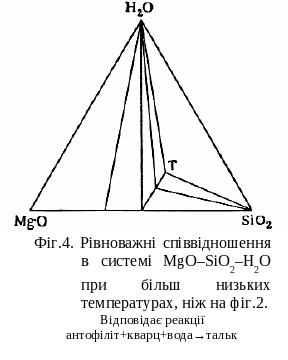 пряжених фаз. За цією фігурою можна визначити фазову асоціацію для шихти будь-якого складу в широких межах зміни температури і тиску. Розглянемо зміни, що відбуваються в шихті, що складається із серпентину. Серпентин стабільний при низьких температурах. Нагрівання системи приводить до утворення асоціації форстериту, тальку та води (точка х). При подальшому нагріванні з’являється асоціація форстерит – антофіліт – вода; для ще більш високих температур характерна присутність форстериту, енстатиту та води. Інший спосіб зображення стабільних фазових асоціацій в даній системі показаний на фіг.6, він незвичайний , але дуже інформативний, хоча і має недоліки, що полягають в обмеженні величини тиску води і можливості нанесення на діаграму лише фаз, стабільних в присутності надлишку води. Не дивлячись на те, що моноваріантні криві визначають максимальні межі стабільності різних мінералів або мінеральних груп, до рішення проблеми полів стабільності в цілому варто застосовувати дуже обережно; в цих випадках необхідно приймати до уваги всю мінеральну асоціацію. На фіг.4. крива, що починається близько 500єС, визначає верхню межу стабільності серпентину. Крива показує максимальну стійкість серпентину в чистому вигляді і в умовах тиску води. В присутності бруситу стабільність серпентину сильно понижується. Моноваріантна реакція:
пряжених фаз. За цією фігурою можна визначити фазову асоціацію для шихти будь-якого складу в широких межах зміни температури і тиску. Розглянемо зміни, що відбуваються в шихті, що складається із серпентину. Серпентин стабільний при низьких температурах. Нагрівання системи приводить до утворення асоціації форстериту, тальку та води (точка х). При подальшому нагріванні з’являється асоціація форстерит – антофіліт – вода; для ще більш високих температур характерна присутність форстериту, енстатиту та води. Інший спосіб зображення стабільних фазових асоціацій в даній системі показаний на фіг.6, він незвичайний , але дуже інформативний, хоча і має недоліки, що полягають в обмеженні величини тиску води і можливості нанесення на діаграму лише фаз, стабільних в присутності надлишку води. Не дивлячись на те, що моноваріантні криві визначають максимальні межі стабільності різних мінералів або мінеральних груп, до рішення проблеми полів стабільності в цілому варто застосовувати дуже обережно; в цих випадках необхідно приймати до уваги всю мінеральну асоціацію. На фіг.4. крива, що починається близько 500єС, визначає верхню межу стабільності серпентину. Крива показує максимальну стійкість серпентину в чистому вигляді і в умовах тиску води. В присутності бруситу стабільність серпентину сильно понижується. Моноваріантна реакція:
брусит + серпентин → форстерит + водяна пара
відбувається при температурах, значно менших температури розкладання серпентину (як показує суміжна низькотемпературна крива). Інші присутні в породі фази можуть викликати додаткове зменшення області стабільності мінералу. що розглядається. Варто нагадати, що природна асоціація утворюється під впливом різних режимів тиску, а не лише при тискові води, як показано на діаграмі; це також впливає на розміри областей стабільності мінералів.
Фіг.5. Мінеральні асоціації в системі MgO – SiO2 – H2O при тисках води менше 5кбар (зліва) і 30 кбар (справа).
Br – брусит; Cо – коусит; En – енстатит; Fo – форстерит; Pe – периклаз; Qz – кварц; Sp – серпентин; Ta – тальк.
Другие работы по теме:
Системи фізичних одиниць величин
Реферат на тему: Системи фізичних одиниць величин Історично першою системою одиниць фізичних величин була ухвалена 7 квітня 1795 року Національними зборами Франції метрична система мір. До її складу увійшли одиниці довжини, площі, об'єму та ваги, в основу яких було покладено дві одиниці: метр та кілограм.
Політичний режим і політична влада
Тема: . ПЛАН 1. Режим як найважливіший фактор функціонування політичної системи суспільства. 2. Політична влада та її сучасні концепції. 3.Функції і тенденції політичної влади.
Вегетативна нервова система
Вегетативна нервова система План: Загальне поняття про вегетативну (автономну) нервову систему. Особливості будови вегетативної нервової системи.
Організація роботи з програмою VirtualBox
Основні способи тестування роботи паралельної системи. Функціональне тестування та тестування загальної швидкості. Способи організації та налаштування кластера. Програма для створення віртуальних операційних систем шляхом виділення ресурсів комп'ютера.
Синтез системи оперативної обробки мінімальної конфігурації
Еverest як програма для перегляду інформації про апаратні і програмні конфігурації комп'ютера, її структура та принцип роботи, значення та функціональні особливості. Обчислення середнього часу відповіді та вартості СОО. Методи діагностики Linux.
Особливості використання САПР технолога–програміста
Характеристика "Турбо САП" - універсальної системи автоматизованого проектування керуючих програм для верстатів з ЧПК. Загальне призначення, програмне забезпечення, експлуатаційні можливості. Специфіка роботи з інтерактивною графічною оболонкою системи.
Математична модель вимірювальної системи в середовищі Delphi
Курсова робота Математична модель вимірювальної системи в середовищі Delphi АНОТАЦІЯ Опис програми містить загальний опис алгоритмів головної програми та допоміжних на рівні блок-схем, а також більш детальний опис розробленої програми на рівні програмного коду.
Метод виокреслення лінійно незалежних векторів
1.Нехай V – не порожня підмножина векторів із Rm, коли з умов А є V, В є V випливає, що при L є R, B є R вектор La+ Bb є V. Візьмемо систему векторів а1, а2..., аn, що належать Rm. Множина всіх лінійних комбінацій цих векторів.
Тренд-аналіз геологічних даних
В складних умовах геологічної будови об’єктів при мозаїчному характері розподілу локальних аномалій ознаки, яка вивчається, виділення напрямків регіональної тенденції його ззміни часто представляє важку задачу при традиційному графічному зображенні, оскільки при цьому звичайно вносяться суб’єктивні представлення априорних геологічних концепцій.
Основні функції Національного банку України
Назва реферату : Основні функції Національного банку України Розділ : Банківська справа Основні функції Національного банку України Національний банк України – найважливіша ланка всієї банківської системи держави. На відміну від багатьох інших відомств, які постали на ґрунті колишніх республіканських чи союзних, НБУ являє собою принципово нову структуру.
Методичні підходи в імітаційному моделюванні
Тема : . Загальний аналіз альтернативних підходів в імітаційному моделюванні. Дискретне імітаційне моделювання. 1. При розробці імітаційної моделі аналітику, а в даному випадку розробнику, потрібно вибрати конкретну концептуальну схему для опису системи, що моделюється. Ця схема будується на визначеному методологічному підході, в рамках якого сприймаються і описуються функціональні взаємозв’язки системи.
Метод орієнтованих графів
Лекція 37 . Можна виключити вершину . Для цього стрілки продовжують так, ніби вузла і не було. В діамагнетику вказується - коефіцієнт при виключеній вершині.
Поняття та основні характеристики податкових систем
Базуючись на філософській концепції, що «система — це сукупність елементів, які перебувають у відношеннях і зв'язках один з одним, що утворює цілісність, єдність», і керуючись тим, що кожний компонент системи, в свою чергу, можна розглядати як окрему систему, а кожна система є одним із компонентів більш широкої системи, можна дати таке визначення поняття податкової системи.
Фізіологія судинної системи
фізіологія судинної системи Кругообіг крові – безперервний рух крові по судинах. Серце виштовхує кров періодично. Швидкість руху крові залежить не тільки від різниці тисків, але й від ширини кровоносного русла. Хоч аорта є найширшою судиною, але вона одна в організмі і нею протікає вся кров, що виштовхується лівим шлуночком.
Робота в ОС Ms-Dos Загрузка основні файли внитрішні та зовнішні команди ос Ms-Dos
Завантаження MS-DOS починається відразу після «микання комп'ютера.. Є три основні файли операційної системи. Завантажувач заносить з диска до оперативної пам'яті системи: програми IO.SYS (модуль уведення/виведення) та MSDO&SYS (основний модуль). Після цього до оперативної пам'яті заноситься файл командного процесора COMMAND.COM, який забезпечує виконання так званих внутрішніх команд операційної системи.
Лекция 5A Манипуляторы
Маніпулятори За типом керування маніпулятори поділяються на дві основні групи: маніпулятори з ручним та автоматичним управлінням. Маніпулятори з ручним управлінням не мають самокерування. В їхній системі автоматичного регулювання завжди присутня людина. Оскільки рухи цих маніпуляторів синхронно чи паралельно наслідують дії оператора чи копіюють їх, вони називаються синхронні, паралельні та копіювальні маніпулятори, чи маніпулятори системи Master-Slave (M-S-Системи).
Структура і склад по САПР
РЕФЕРАТ на тему: СТРУКТУРА І СКЛАД ПО САПР СТРУКТУРА І СКЛАД ПО САПР Програмне забезпечення САПР поділяється на загальносистемне, базове і прикладне.
Методи контрацепції
Міністерство охорони здоров'я Коломийське медичне училище ім. І.Я.Франка Гурткова робота з акушерства на тему: “Методи контрацепції” Підготував студент
Операційні системи види структура склад
Реферат на тему: Характеристики операційних систем Різні операційні системи, до яких відносять OC MS-DOS, OC Windows, OC Linux, OC Unix та багато інших не таких популярних, використовують ті чи інші можливості обслуговування компонентів комп’тера і організації діалогу з користувачем. До числа основних характеристик операційних систем відносяться: розрядність, підтримка багатопроцесорності, багатозадачності, підтримка багатокористу-вацького режиму.
Кровообіг 2
Реферат на тему: Кровообіг Основне значення системи кровообігу – це постачання кров’ю органів і тканин. Кров безперервно рухається по судинах. До системи кровообігу відносять серце і судини – кровоносні і лімфатичні.
Грошова система 4
ТЕМА. ГРОШОВА СИСТЕМА. Грошова система це форма організації грошового обороту в країні, встановлена загальнодержавними законами. Елементи грошової системи України:
Орган система органів
Тема: Орган, система органів” ПЛАН Визначення, що таке орган. Принципи будови органів. Загальна характеристика системи органів. ПОНЯТТЯ ПРО ОРГАН, СИСТЕМУ ОРГАНІВ ТА ОРГАНІЗМ


 снування чотирьох фаз в трикомпонентній системі говорить про наявність моноваріантність умов (так як P + F = C + 2, 4 + F = 3+2, F = 1). Ця моноваріантна реакція являється функцією тиску і температури і може бути представлена у вигляді моноваріантної лінії (фіг.3). Стабільні співвідношення фаз з кожної сторони від лінії зображуються графічно у вигляді відповідних рівноважних трикутників.
снування чотирьох фаз в трикомпонентній системі говорить про наявність моноваріантність умов (так як P + F = C + 2, 4 + F = 3+2, F = 1). Ця моноваріантна реакція являється функцією тиску і температури і може бути представлена у вигляді моноваріантної лінії (фіг.3). Стабільні співвідношення фаз з кожної сторони від лінії зображуються графічно у вигляді відповідних рівноважних трикутників. пряжених фаз. За цією фігурою можна визначити фазову асоціацію для шихти будь-якого складу в широких межах зміни температури і тиску. Розглянемо зміни, що відбуваються в шихті, що складається із серпентину. Серпентин стабільний при низьких температурах. Нагрівання системи приводить до утворення асоціації форстериту, тальку та води (точка х). При подальшому нагріванні з’являється асоціація форстерит – антофіліт – вода; для ще більш високих температур характерна присутність форстериту, енстатиту та води. Інший спосіб зображення стабільних фазових асоціацій в даній системі показаний на фіг.6, він незвичайний , але дуже інформативний, хоча і має недоліки, що полягають в обмеженні величини тиску води і можливості нанесення на діаграму лише фаз, стабільних в присутності надлишку води. Не дивлячись на те, що моноваріантні криві визначають максимальні межі стабільності різних мінералів або мінеральних груп, до рішення проблеми полів стабільності в цілому варто застосовувати дуже обережно; в цих випадках необхідно приймати до уваги всю мінеральну асоціацію. На фіг.4. крива, що починається близько 500єС, визначає верхню межу стабільності серпентину. Крива показує максимальну стійкість серпентину в чистому вигляді і в умовах тиску води. В присутності бруситу стабільність серпентину сильно понижується. Моноваріантна реакція:
пряжених фаз. За цією фігурою можна визначити фазову асоціацію для шихти будь-якого складу в широких межах зміни температури і тиску. Розглянемо зміни, що відбуваються в шихті, що складається із серпентину. Серпентин стабільний при низьких температурах. Нагрівання системи приводить до утворення асоціації форстериту, тальку та води (точка х). При подальшому нагріванні з’являється асоціація форстерит – антофіліт – вода; для ще більш високих температур характерна присутність форстериту, енстатиту та води. Інший спосіб зображення стабільних фазових асоціацій в даній системі показаний на фіг.6, він незвичайний , але дуже інформативний, хоча і має недоліки, що полягають в обмеженні величини тиску води і можливості нанесення на діаграму лише фаз, стабільних в присутності надлишку води. Не дивлячись на те, що моноваріантні криві визначають максимальні межі стабільності різних мінералів або мінеральних груп, до рішення проблеми полів стабільності в цілому варто застосовувати дуже обережно; в цих випадках необхідно приймати до уваги всю мінеральну асоціацію. На фіг.4. крива, що починається близько 500єС, визначає верхню межу стабільності серпентину. Крива показує максимальну стійкість серпентину в чистому вигляді і в умовах тиску води. В присутності бруситу стабільність серпентину сильно понижується. Моноваріантна реакція:


