Приложение 1
Конкретные примеры о методах реализации межпредметных связей.
1. Вопросы межпредметного содержания:
а) Вспомните (из курса географии) основные месторождения в России:
алмаза
поваренной соли
каменного угля
К уроку 1 по теме 4 “Подгруппа углерода”.
б) Вспомните определение (из курса физики) ион.
К уроку 3 “Угольная кислота и ее соли”, лабораторный опыт 7.
в) Вспомните (из курса биологии) сущность процесса фотосинтеза.
К уроку 2 “Оксиды углерода”.
2. Межпредметные задачи:
а. В чем основное отличие структуры и физических свойств кристаллических и аморфных (стеклообразных) тел? При ответе используйте сведения, полученные из курса физики.
б. Какое свойство угольной кислоты вы будете привлекать для ответов на вопросы:
- Как доказать, что данное вещество является солью угольной кислоты?
К уроку 3 “Угольная кислота и ее соли”.
- На каком свойстве основано применение питьевой соды в медицине для снижения кислотности желудочного сока? (из курса биологии, анатомии)
К уроку 3.
- Почему известняк (в размолотом виде) применяют для уменьшения кислотности почвы (известкование почвы)? (из курса географии, биологии)
К уроку 3 “Круговорот углерода в природе”.
3. Домашнее задание межпредметного характера.
а) Подготовьте реферат на тему “Парниковый эффект и углекислый газ” (из курса географии – “Загрязнение атмосферы” – одна из глобальных проблем человечества).
К уроку 2 “Оксиды углерода”.
б. Составьте кроссворд на тему “Подгруппа углерода”.
Примерный кроссворд:
Вопросы: 1. Самый большой из всех известных алмазов.
2. Одна из аллотропных модификаций углерода.
3. Ученый, впервые получивший углекислый газ.
4. Основная составная часть природного горючего газа (w = 60 – 99%).
5. Соединение углерода с кремнием.
6. Процесс в природе поглощения углекислого газа растениями при освещении.
7. Соединение углерода с металлами.
8. Элемент 4 группы, главной подгруппы возглавляющий ее, имеет относительную атомную массу 12,011, порядковый номер 6.
| 8 | ||||||||||||||
| 1 | к |
у |
л | и | н | а | н | |||||||
| 2 |
г |
р | а | ф | и | т | ||||||||
| 3 |
л |
а | в | у | а | з | ь | е | ||||||
| 4 | м |
е |
т | а | н | |||||||||
| 5 | к | а |
р |
б | о | р | у | н | д | |||||
| 6 | ф |
о |
т | о | с | и | н | т | е | з | ||||
| 7 | к | а | р | б | и |
д |
4. Межпредметное наглядное пособие:
а) Подготовить на основе данных о круговоротах воды, кислорода схему “Круговорот углерода в природе”.
К уроку 3.
б) Составить диаграмму влияния давления и температуры на растворимость оксида углерода 4 (из курса физики).
5. Химический эксперимент:
а) Адсорбция активированным углем.
6. Уроки межпредметного обобщения или тематические задания:
а) Межпредметная конференция по глобальным проблемам, источникам бед, то есть загрязнителей – обобщение по подгруппам кислорода, азота, углерода.
Приложение 10.
Физиологические действия углекислого газа на человека.
Углекислый газ являясь продуктом дыхания, не поддерживает его. Однако в малых количествах углекислый газ для человека не ядовит, как это следует из постоянного нахождения его в наших легких. Более того, в малых количествах он физиологически полезен и необходим, так как возбуждающе действует на дыхательный центр, приводящий в действие мускулы грудной клетки. Начиная с первого вдоха, вызванного первой перегрузкой крови диоксидом углерода во время акта рождения, мускулатура нашей грудной клетки управляется без вмешательства сознания нервными импульсами дыхательного центра, вызываемого накоплением в крови CO2.
Поэтому углекислый газ подмешивается к кислороду, предназначенному для оживления мнимоумерших при помощи аппаратов искусственного дыхания, иначе дыхание может не возобновиться. Переход одного физиологического качества CO2 (физиологической полезности в малых концентрациях) в прямо противоположное (удушающее действие) является результатом нарастания количества содержания CO2 в воздухе. Накопление CO2 в воздухе затрудняет отдачу в легких CO2, накопившейся в венозной крови, а длительная перегрузка крови CO2 вредна. Поэтому в школах должны проводиться замеры, что бы ПДК по CO2 не превышала нормы. (В США ПДК – 9000 мг/ м3 до 0,5%), постоянно проветриваться кабинеты и вести его озеленение (биоиндикаторы – традесканция, хлорофитум).
Последствия от накопления в воздухе CО2 представлены в таблице.
|
Концентрация CO2 |
Эффект |
|
0,25 – 1% 2,5 – 5% 7% 10% 12 – 15% |
изменение функции внешнего дыхания и кровообращения головная боль, раздражение верхних дыхательных путей, чувство тепла в груди, увеличение легочной вентиляции за счет учащения и углубления дыхания, учащение сердцебиений, повышение кровяного давления потливость, шум в ушах, учащение сердцебиений, головокружение, возможны психическое возбуждение, рвота, снижение температуры тела, нарушение зрения (темновой адаптации, аккомодация, светобоязнь) проявления поражения головного и спинного мозга мучительное состояние, головная боль, прилив крови к лицу, оцепенение обморок и через некоторое время смерть |
Из таблицы следует, что дышать воздухом, обогащенным СО2, становится трудно лишь при приближении содержания СО2 во вдыхаемом воздухе к содержанию СО2 в выдыхаемом нами воздухе 5%, а угроза обморока наступает при содержании СО2, какое получится в легких, если мы, насколько сможем долго, задержим дыхание (например при нырянии в воду).
Приложение 11
Химический вечер по теме "Суд над алмазом"
Действующие лица:
Ведущий
1-ый историк
2-ой историк
Алмаз
Председатель суда
Народный заседатель (2 человека)
Адвокат
Государственный обвинитель
Секретарь суда
Свидетели: важная дама
Владелец алмаза “Южная Земля”
Ростовщик-богач
Девушка
Работница часового завода
Рабочий со стекольного завода
Работница электролампового завода
Инженер нефтяных разработок
Ученый из зала суда
Ведущий: Сегодня в нашем школьном зале проходит суд серьезный, важный. Судить алмаз мы будем строго: принес он людям горя много. Но прежде, чем начнется заседание, послушайте одно сказание.
Входят историки со свитками в руках:
1-ый историк: Нас справку здесь просили дать.
2-ой историк: Попробуй кратко рассказать.
1-ый историк: Исторической родиной алмаза считают Индию. Впервые алмазы из Индии попали к древним грекам, доказательством чего служит хранящаяся в британском музее бронзовая статуэтка 5 века до нашей эры, у которой вместо глаз были вставлены два неошлифованных алмаза.
2-ой историк: Древним грекам безусловно была известна необычайная твердость алмаза. Недаром слово “Алмаз” произносится от греческого “Адамас” (Разворачивает второй свиток со словами): “непреодолимый”, “непобедимый”, “несокрушимый”, “неуловимый”.
1-ый историк: В древности алмазу приписывали необыкновенные сверхъестественные свойства; он мог решить судьбу человека, исцелить от недуга, выявить истину. Алмаз считали талисманом, приносящим счастье в сражении.
2-ой историк: Из истории известно, что французский король Карл Смелый во всех битвах имел при себе свои драгоценности. В битвах при Нанси шлем Карла украшал большой бриллиант весом 5 каратов (карат равен 0,2 г). Однако алмаз не отвел копья от груди короля. В этом сражении Карл Смелый был убит.
1-ый историк: Много лет спустя алмаз, некогда украшавший шлем Карла Смелого, при сражении под Ватерлоо находился в кармане Наполеона I. Неожиданно во время сражения Наполеон побледнел и схватился за карман.
- Мой бриллиант, - крикнул он не своим голосом. Свита императора бросилась искать потерянную драгоценность. Наполеон несколько минут наблюдал за ними, потом вскочил на чью-то лошадь и ускакал на правый фланг своих войск.
Ведущий: Исход сражения всем известен. Бриллиант тут право не причем. Был или не был он на месте, конец сражения предрешен.
2-ой историк: Вторым местом нахождения алмазов является Бразилия. Самыми богатыми находками славился округ Диаманди. Алмазы в этом округе были не крупные. Но однажды здесь был найден алмаз, превышающий 100 каратов. Алмаз этот в истории был известен под названием “Южная Звезда”.
1-ой историк: “Южная Звезда” унесла много жизней, подвергнув в прах суждение о том, что алмаз и бриллиант приносят людям счастье.
2-ой историк: Самым большим алмазом является алмаз под названием “Куллипон”, найденный в Южной Африке в начале нашего века. Вес его 3106 каратов.
(разворачивает таблицу)
1-ый историк: Вторым по величине алмазом был “Экспельспор”, найденный там же в Южной Африке весом 995 каратов.
2-ой историк: У нас в музее хранится алмаз “Орлов”. И интересна его история. Примерно 300 с лишним лет назад в далекой Индии нашли ивидолову голову, замуровали как могли.
Прошли года и шах Надир
Войсками Дели захватил.
Он грабил, мучил, всех губил.
Алмаз припрятать не забыл.
Затем игрой судьбы алмаз
В Россию прибыл как-то раз
Придворный, важный ювелир,
Его Орлову подарил
А граф Орлов любимцем был,
Ведь это не секрет.
Алмаз царице подарил-
Подарка лучше нет.
1-ый историк: Капитализм по-настоящему открыл в алмазе замечательное свойство - твердость и алмаз был низвергнут с блестящего трона в душный фабричный цех в шахтный ствол. Камень-бездельник бесповоротно уступил место камню-работнику. Всем сидящим в зале должна быть известна страшная, кровопролитная, англо-бурская война, которая открыла новую эпоху империалистических войн. Итогом этой войны было то, что под вывеской “Английские синдикаты” империалисты Англии все южно-африканские алмазы земли. Эти алмазные синдикаты существуют и поныне. На протяжении всей своей истории они вели жестокую борьбу со всеми возникающими алмазными монополиями, как спрут, втягивая их в свою работу.
2-ой историк: Но Соединенные Штаты Америки прилагают все усилия, чтобы подчинить алмазный синдикат своему влиянию и наложить свою лапу на мировую алмазную промышленность. Страсти не утихают.
1-ый историк: Открытие наших якутских алмазов нанесло огромный удар по карману алмазного синдиката.
2-ой историк: Но вот на подмогу природным алмазам пришел алмаз искусственный.
1-ый историк: О получении драгоценных камней люди мечтали столетиями. В разных странах, в разные времена пытались получить алмаз. Но все попытки терпели фиаско.
2-ой историк: Они родились в институте физики высоких давлений, руководствуемым Героем социалистического труда академиком Верещагиным. С 1963 года началось промышленное изготовление искусственных алмазов.
1-ый историк: По твердости искусственные алмазы не уступают природным, но они более хрупкие. Хрупкость - это только достоинство. Дело в том, что в бурах, на шлифовальных станках искусственные алмазы крошатся, а этим самым как бы затачиваются.
2-ой историк: Более 2/3 алмазов, применяемых в технике, шло на изготовление шлифовальных инструментов. Все это количество природных алмазов полностью заменяют искусственные, полученные из графита.
Ведущий: ... Все ... Ваше время истекло. Сейчас начнется заседание. (На сцену входит секретарь суда с папкой, ее кладет на стол секретаря.)
Секретарь: Ввести подсудимого. (Вводят “Алмаз” . На груди на листке бумаги вычерчена кристаллическая решетка алмаза.)
Секретарь: Встать, суд идет. (На сцену выходит председатель суда, народные заседатели , прокурор, адвокат. Члены суда садятся. Адвокат и прокурор занимают свои места. Зал садится).
Председатель суда: Наше судебное заседание ведется в следующем составе:
Председатель суда
Адвокат
Секретарь суда
Народный обвинитель
Народный заседатель: Подсудимый на месте?
Алмаз: Я здесь!
Председатель суда: Свидетели явились все?
Секретарь: Явились все.
Председатель суда: Тогда приступим к делу. Заполним вначале анкету. Пункт 1 - фамилия подсудимого?
Алмаз: Углерод
Председатель суда: Имя?
Алмаз: Алмаз
Председатель суда: Год вашего рождения?
Алмаз: 5-ый век до нашей эры.
Председатель суда: Ваш постоянный адрес?
Алмаз: Периодическая система Д.И. Менделеева, II период, 4-я группа, номер 6.
Председатель суда: Род занятий?
Алмаз: Род занятий назвать очень трудно. Много лет украшением служил, талисманом иные считали, пряча глубже в карманы свои и мечтали со мной о богатстве ненасытные люди Земли. Затем меня в шахту спустили, превратили в сверло, долото. Моим порошком и сверлили, точили, и твердость ценили высоко.
Но вот меня стража схватила,
Зачем, почему, не пойму.
Меня в преступлении обвинили.
Нет! Быть виновным не могу!
Председатель суда: Разберемся сейчас в деле том. Здесь алмазу предъявлен иск.
Алмазу предъявили обвинение. Он виновен в смерти невинных людей, был причиной Англо-бурского сражения. Воспитывал алчность, стяжательство, страх. Причиной был разорения и горя. Немало с ним люди пролили слез. И вот нам судить его поручили.
Следствие долго дело его изучало.
Чтобы понятно было - свидетелей позвало
Сейчас их показания послушаем мы с вами,
Слово предоставляю важной даме.
(Входит свидетельница - важная дама)
С ним счастье я нашла.
Богатство в нем, почет, любовь
Сквозь жизнь я пронесла.
Ну что ж, что многие гниют в лачугах на земле,
Их труд принес богатство мне,
Я счастлива вполне.
Горит алмазами браслет,
Бриллиантами кольцо.
Он бросает нежный свет, на руки и лицо.
В оправе тонкой, золотой
Алмаз блестит, горя.
В его защиту голос свой
Здесь поднимаю я.
Председатель суда: Сказали все? Представим слово другому. Дельцу, владельцу земли Южной Африки округа Диаманди.
Делец: Земля моя, земля моя!
В ней найден был бриллиант!
Теперь я буду богачем!
А - следовательно - мудрецом,
Недаром “Южная звезда”
Его назвали так тогда.
Ко мне он в руки попадет,
И много счастья принесет.
А арендатор хитрый мой
Присвоил он бриллиант, у девушки, рабыни той,
Кем найден был он раз.
Девица юная пошла, и думала теперь:
“Свободу я себе куплю, подругам всем в пример”
Бриллиант хозяин отобрал, свободу, правда, обещал.
Но не дождалась она и в реку бросилась сама.
Но я бриллиант тот отберу, мерзавца в яму заточу.
Пускай гниет он в яме той, и помнит, что бриллиант лишь мой.
Председатель суда: Его вы поняли слова, и хоть ошибка велика, на много нам открыл глаза. Других послушаем друзья. Здесь с завода часового слова просит товарищ Орлова.
Орлова: На часовом заводе встречались мы не раз, чтоб время было точно - необходим алмаз. Алмаз ведь не случайно вошел в тот механизм. Который помогает украсить нашу жизнь.
Чтоб точно он работал и время сохранял.
Чтоб каждую минуту он в дело превращал.
Алмаз часам продали, велели им служить.
Каждую минуту и каждый час хранить.
Председатель суда: Свидетель - он ростовщик, богач известный, и для него найдется место.
Ростовщик: Спускаюсь я в подвал, все мрачно и темно.
Я спускаюсь ниже, ниже, вот дверь, за дверью все:
Богатство, счастье, радость жизни.
Я открываю дверь, вхожу, здесь все знакомо мне:
Мои ларцы, шкатулки, сундуки. Я открываю их и темный
Мой подвал сверкает светом ярче солнца.
Алмазы в руки я беру, вся жизнь моя лишь в них одних.
Жену на них я обменял, и сына продал я за них.
Алмазы! Вас как жизнь люблю! И что бы ни было со мной,
В подвал я в полночь прихожу. Здесь забываем все земное.
Председатель суда: Свидетель следующий - девушка.
Девушка: Зачем тогда нашла алмаз, поверьте, я не знаю.
Я камни видела не раз, такого не встречала.
Все говорят алмаз-бриллиант приносит счастья много.
И лишь мечтала иногда о жизни я свободной,
Была тогда я молода, была всегда веселой.
Алмаз всю жизнь мне отравил, его ведь отобрали...
И сколько слез пролито с ним, друзья со мной страдали.
И я не выдержав потерь, решила утопиться.
Не нужен мне алмаз теперь, в нем счастье не таится.
Председатель суда: Вот со стекольного завода свидетель. Рабочий Славов. Вам слово.
Рабочий Славов: Стекло пришлось резать не раз, а много раз. И вот я благодарность пою тебе алмаз. Где тверже материал сумеем мы найти. Наука все искала - подобных не найти. Его создать решили, искусственно в цехах. И в жизнь воплотили в огромнейших бурах.
Председатель суда: Показания исчерпаны у нас. Слушали мы много “за” и “против”. Сейчас Вам слово предоставлю - Государственному обвинителю.
Государственный обвинитель:
Свидетелей здесь было много. В устах их истина была.
Здесь обвиняли очень строго. Здесь защищали без меня.
Но я не буду голословен, сошлюсь на факты как всегда.
По-моему алмаз виновен и привлечен к суду не зря.
Мой первый пункт: вина алмаза, что в людях жадность пробудил.
Что бар поддерживал он страстно, бездельникам сродни он был.
Его увидя, забывали о чести, о своих друзьях.
Детей, жену - мы здесь слыхали, все продавали на торгах.
Мой пункт второй - он жизнь губил, не счесть сейчас людские слезы.
И кровь, что капала из жил. Разбив мечты, былые грезы,
Вы скажете, что старое прошло. Дела и времена сейчас другие.
Дела сейчас поистине большие. Но надо помнить, что алмаз
Хорош лишь если... Трудом людей он освящен,
И людям служит верно он. Но надо справедливым быть.
Да, роль его важна, но разве можно позабыть, как власть его страшна
Мы так оставить не могли, и наказание для него я требую сейчас.
Председатель суда: Слово предоставляется адвокату.
Адвокат: Сидящим здесь в зале должно быть известно, что роль моя в этом процессе сложна. Но царь всех камней, речь моя будет в защиту тебя. Скажите: можно ли принцессу винить за то, что она прекрасна? И юноша с сердцем, способным любить, в красу ту влюбляется страстно. И ради того, чтоб красой обладать, готов на убийство, на кровь и на муки. Вы в зале, кто в зале, кто мысль мою мог угадать, берите алмаз на поруки?
Председатель суда: Материал исчерпан. Вопросов нет? Нет. Суд удаляется на совещание.
Ученый из зала суда: Постойте, я хочу сказать: прошу алмаз не осуждать. Возьмем его мы на поруки. Пускай послужит он науке.
Секретарь: Встать, суд идет. (Входит суд, все стоят. Председатель открывает папку, читает приговор.)
Приговор суда:
Судейская коллегия заслушала делегацию по обвинению Гражданина Углерода Алмаза, год рождения - 5-ый век до нашей эры, и вынесла приговор: Алмаз оправдать согласно ст. 48, 215 и 49 Кодекса Союза равноправных элементов системы Д.И. Менделеева.
Статья 48 гласит:
Член Союза равноправных элементов, приносящих пользу хотя бы в одной из отраслей промышленности, может быть осужден, независимо от состава преступления, сроком не более одного года лишения свободы.
Статья 215, пункт “а” гласит:
Член Союза равноправных элементов, работающих и приносящих пользу более, чем в 3-х отраслях, уважаемый обществом и необходимый людям, обвинен быть им не может, поэтому обвиняемый алмаз освобождается из-под суда и следствия и может с полным правом честного элемента продолжать служить людям.
Приговор суда окончательный и обжалованию не подлежит.
Секретарь суда: Алмаз из-под стражи освободить. (Часовые уходят.)
Алмаз: Я очень благодарю вас,
Растрогал приговор меня.
Я понял: суд вели друзья
И путь мне верный указали.
О, я готов служить всегда
Большим, великим начинаниям.
Литература для вечера:
1. “Чудесный камень” Г.С. Бурмин
2. Химия для Вас А.М. Юдин
3. “Химия для любознательных” Э.Гроссе, Х.Вайсмантель
4. Книга для чтения по неорганической химии, часть II
5. Занимательная геохимия А.Е. Ферсман
Приложение 12
Определение молекулярного состава углекислого газа(экспериментальная часть)
Рассмотрим несколько методик получения углекислого газа:
1. Разложение гидрокарбонатов при нагревании.
Ход работы
В штативе закрепляем сухую колбу Вюрца, поместив туда 3,75 г сухого гидрокарбоната калия. Колбу соединяем газоотводной трубкой с соединенными между собой колбами Тищенко (первая заполнена водой для очистки от твердых частиц, от хлороводорода, вторая - концентрированной серной кислотой для сушки газа от паров воды) и выходящей из последней газоотводной трубки в колбу-приемник очищенного газа. Ведем нагревание колбы спиртовкой. Примерно при температуре 105°C начинается разложение. Сама реакция протекает с приемлимой скоростью лишь в интервале 120 -200°C.
Уравнение реакции
2 NaHCO3 ® Na2CO3+H2O+CO2
Наблюдения
Получаемый газ собираем в колбу на 500 мл (заполнение ведем до получения постоянной массы, проверку заполненности колбы ведем по горящей лучине), он получается очень чистым, реакция проходит очень интенсивно. Газ, таким образом, получаем в три пробега.
Установка
2. Разложение малахита.
Ход работы
В штативе закрепляем сухую колбу Вюрца, поместив туда 5 г малахита. Колбу соединяем газоотводной трубкой с соединенными между собой колбами Тищенко (первая заполнена водой для очистки от твердых частиц, вторая - концентрированной серной кислотой для сушки газа от паров воды) и выходящей из последней газоотводной трубки в колбу-приемник очищенного газа. Ведем нагревание колбы спиртовкой. Реакция начинает идти при температуре 100°C, идет интенсивно при температуре 150°C.
Уравнение реакции
Cu2(OH)2CO3 ® 2CuO+H2O+CO2
Наблюдения
Получаемый газ собираем в колбу на 500 мл (заполнение ведем до получения постоянной массы, проверку заполненности колбы ведем по горящей лучине), реакция протекает очень быстро и интенсивно с образованием черного порошка оксида меди (II). Проделываем три пробега.
Установка та же, что и в опыте 1.
3. Термическое разложение карбоната магния.
Ход работы
В штативе закрепляем сухую колбу Вюрца, поместив туда 2 г магнезита. Колбу соединяем газоотводной трубкой с соединенными между собой колбами Тищенко (первая заполнена водой для очистки от твердых частиц, вторая - концентрированной серной кислотой для сушки газа от паров воды) и выходящей из последней газоотводной трубки в колбу-приемник очищенного газа. Ведем нагревание колбы спиртовкой.
Уравнение реакции
MgCO3®MgO+CO2
Наблюдения
Для разложения необходима температура 540°C. Данной температуры достичь не удалось, газ не был получен.
Установка та же, что и в опыте 1.
4. Взаимодействие мрамора с соляной кислотой.
Ход работы
В проверенный на герметичность аппарат Киппа закладываем 3 г карбоната кальция и наливаем раствор соляной кислоты (1: 2,5). Аппарат Киппа соединяем газоотводной трубкой с соединенными между собой колбами Тищенко (первая заполнена водой для очистки от твердых частиц, вторая - концентрированной серной кислотой для сушки газа от паров воды) и выходящей из последней газоотводной трубки в колбу-приемник очищенного газа.
Уравнение реакции
CaCO3+2HCl®CaCl2+CO2+H2O
Наблюдения
Получаемый газ собираем в колбу на 500 мл (заполнение ведем до получения постоянной массы, проверку заполненности колбы ведем по горящей лучине), реакция идет умеренно. Газ получается чистый. Делаем три пробега.
Установка
5. Декарбоксилирование карбоновой кислоты.
Ход работы
В штативе закрепляем сухую колбу Вюрца, поместив туда 2,5 г лимонной кислоты. В колбу Вюрца помещаем катализатор - медь и ведем нагревание. Колбу соединяем газоотводной трубкой с соединенными между собой колбами Тищенко (первая заполнена водой для очистки от твердых частиц, вторая - концентрированной серной кислотой для сушки газа от паров воды) и выходящей из последней газоотводной трубки в колбу-приемник очищенного газа.
Уравнение реакции
Наблюдения
Реакция декарбоксилирования лимонной кислоты идет очень медленно даже в присутствии медного катализатора. При температуре °С лимонная кислота начинает закипать и разлагаться. В результате опыта получили небольшое количество углекислого газа, т.к. все дикарбоновые кислоты трудно декарбоксилируются.
Столбиковая диаграмма относительной ошибки
Сводная таблица результатов
|
масса колбы с пробкой и воздухом m1, г |
масса колбы с пробкой и СО2 m2, г |
масса воздуха в колбе m3, г |
масса колбы с пробкой m4, г |
масса СО2 в колбе m, г |
давление, кПа Р |
температура, град К Т |
объем колбы V |
объем колбы при н.у. V0 |
молярная масса СО2, вычисленная методом |
относительная ошибка, % | ||
| А г/моль | В г/моль | С г/моль | ||||||||||
| разложение гидрокарбоната натрия | ||||||||||||
| 172,51 | 172,91 | 0,7801687 | 171,72984 | 1,18016 | 102,3915 | 296,5 | 0,650 | 0,60478 | 43,86825 | 43,690705 | 43,8682 | 0,31 |
| разложение малахита | ||||||||||||
| 135,27 | 135,69 | 0,8609581 | 134,40905 | 1,290326 | 102,9248 | 297,5 | 0,716 | 0,667494 | 43,462586 | 43,286673 | 43,306715 | 1,24 |
| взаимодействие мрамора с соляной кислотой | ||||||||||||
| 193,69 | 194,06 | 0,7899026 | 192,8801 | 1,179945 | 102,3915 | 296 | 0,657 | 0,612327 | 43,32105 | 43,146258 | 43,166233 | 1,5 |
| декарбоксилирование лимонной кислоты | ||||||||||||
| 135,13 | 135,48 | 0,8428581 | 134,2871 | 1,19283 | 100,5917 | 297 | 0,716 | 0,65337 | 41,04139 | 40,875285 | 40,89207 | 0,7 |
Поправка: берем средние величины результатов.
Приложение 13
Растворенный углекислый газ в воде определяет жизнедеятельность в океане. Углекислый газ является “продуктом питания” фитопланктона. Максимальное содержание углекислого газа приурочено к глубинным слоям воды. Растворимость углекислоты возрастает в холодных водах и уменьшается при нагревании. В связи с этим в зимние месяцы часть углекислого газа переходит из атмосферы в океаническую воду, а летом – обратно.
Углекислый газ принимает участие в химических реакциях, в частности регулирует карбонатное равновесие. Воды, обогащенные углекислым газом, агрессивны по отношению к CaCO3, удаление углекислого газа из воды при ее нагревании способствует осаждению карбонатов. Велика роль углекислого газа в фотосинтезе, в процессе которого образуется органическое вещество. В результате фотосинтеза в океане ежегодно образуется около 1017 г биомассы фитопланктона.
Выяснив, что углекислый газ может поглощать океан как северного, так и южного полушария, ученых заинтересовал еще один вопрос: поглощает ли южная часть Тихого океана углекислый газ во все сезоны года?
Известно, что обильный планктон южного полушария играет важную роль в природном механизме, “выкачивающем” диоксид углерода из атмосферы и отлагающем ее в меловые осадочные породы морского дна. Если его эффективность понизится, количество углекислого газа в воздухе возрастает, что будет способствовать парниковому эффекту, вызывающему глобальное потепление.
На сессии Американского географического союза в декабре 1991 г. были представлены первые материалы о концентрациях углекислого газа в водах южной части Тихого океана в осенний период. Исследования выполняли сотрудники Тихоокеанской лаборатории Национального управления США по изучению океана и атмосферы (НОАА) Р.Фили и П.Мерфи при участии Р.Гаммона – Вашингтонский университет, спонсор исследования – программа НОАА по глобальному изменению климата.
Обобщенные данные непосредственных химических анализов, которые были выполнены с 1984 по 1989 г. в Тихом океане от экватора до Южного полярного круга. Полученные результаты ставят под сомнение представление о роли этой области Мирового океана как активного поглотителя углекислого газа из атмосферы.
На основании прежних исследований считалось, что около половины углекислого газа, поступающего в атмосферу со всей земной поверхности при сжигании ископаемого топлива и сокращении площади лесных массивов, в ней и остается, а другая половина – “пропавший углерод” – поглощается наземными растениями и водами океана, в основном южной частью Тихого океана. Считалось также, что область высоких концентраций углекислого газа в восточной половине южной части Тихого океана находится в приблизительном балансе с областью низких концентраций западной половины.
По мнению Фили, “область высоких концентраций углекислого газа – это те районы, где океан отдает этот газ в атмосферу, и наоборот, в области с низкими концентрациями углекислого газа воды поглощают его из атмосферы”. Однако количество поглощаемой и отдаваемой углекислоты зависит от скорости ветра: чем он сильнее, тем больше углекислого газа переносится через границу вода-воздух. Этот фактор заставил исследователей тщательно проанализировать данные по ветровому режиму южной части Тихого океана. Однако вследствие суровых погодных условий метеонаблюдения на судах велись эпизодически. Пришлось для анализа использовать также имеющийся в НОАА массив сведений о ветрах, которые отмечались китобойными судами в прошлом веке, особенно в полосе между 40 и 50 градусами ю.ш. Эта полоса хорошо известна мореплавателям как “ревущие сороковые”, где скорость ветра превышает 70 км/ч. Обобщенные данные по ветрам были сопоставлены с концентрациями углекислого газа в поверхностных водах и приповерхностных слоях воздуха для оценки потоков поглощаемого или выделяемого углекислого газа в различных районах южной части Тихого океана. Согласно полученным результатам, в осенний сезон в Южном полушарии количество углекислого газа, выделяемого в атмосферу из океана на востоке, почти совпадает с количеством, поглощаемым океаном на западе.
Ученые допускают, что в иные сезоны южная часть Тихого океана действительно является мощным поглотителем углекислого газа. Это вопрос и практика будущего.
Следующий вопрос, который заинтересовал ученых – это механизм осаждения карбонатов в условиях фотосинтеза. Для простоты изобразим это в виде небольшого рисунка (его можно использовать как МП-картосхему на уроках химии и географии).
Рис. 2 Схема осаждения атмосферного углекислого газа, образование морских отложений.
Экспериментально изучена кинетика осаждения CaCO3 при 20°C и 30°C в условиях пересыщений, достигаемых при фотосинтезе в морской воде. Выяснена возможность спонтанного осаждения CaCO3 в условиях Багамской Банки.
Проблема осаждения карбоната кальция в океане привлекает внимание исследователей в течение последних 40 лет. Две основные точки зрения – о выделении CaCO3 исключительно биогенным путем и о спонтанном физико-химическом осаждении непосредственно из морской воды – имеют подтверждения как в экспериментальных работах, так и в результатах натуральных наблюдений. Особенно большое значение придается этой проблеме в связи с интенсивным осаждением карбонатных илов на Багамской Банке, Персидском заливе, которое часто рассматривают в качестве аналога карбонатообразования в древних морях.
Эксперименты по этому вопросу были проведены московскими учеными О.С. Покровским и В.С. Савенко (МГУ им.М.В. Ломоносова). Что же им удалось получить и изучить?
В экспериментах по изучению спонтанного физико-химического осаждения CaCO3 в морской воде была показана возможность непосредственного осаждения карбоната кальция в условиях морской воды, отвечающих районам интенсивного карбонатонакопления. Данные по Багамской Банке подтверждают действие механизма прямого физико-химического осаждения из морской воды. Но имеются многочисленные данные, которые доказывают основную роль в выделении CaCO3 сине-зеленых водорослей. В ходе фотосинтеза происходит значительное увеличение pH, что может приводить к химическому осаждению CaCO3 на внешних поверхностях клеток. Наблюдения показали, что суточные изменения pH в непосредственной близости от скоплений водорослей могут достигать 7,4 – 9,2, что приводит к выпадению CaCO3.
Несмотря на большую роль водного фотосинтеза в осаждении карбонатов, физико-химический анализ этого процесса не проводился, а имеющиеся данные по гомогенному осаждению CaCO3 не могут быть непосредственно использованы в силу изменения концентраций неорганического углерода, растворенных фосфатов, pH, происходящих при фотосинтезе.
Рассмотрим теоретически изменения состава среды, непосредственно примыкающей к фотосинтезирующим клеткам. При фотосинтезе, вследствие реакций образования электронейтральных органических соединений происходит компенсационное выделение ионов OH-, что сопровождается увеличением pH и переходом части ионов HCO3- в CO32-
n H2CO3 ® (CH2O)n + n O2;
n HCO3- + n H2O ® (CH2O)n + n O2+ n OH-;
n CO32- + 2n H2O ® (CH2O)n + n O2+ 2n OH-;
Используя условие электронейтральности – постоянство общей щелочности – Alk
Alk = [HCO3-] + 2[CO32-] + [H2BO3]- + [OH]-
и смешанные константы диссоциации, можно выразить общую концентрацию неорганического углерода Ст как функцию активности ионов водорода (10-pH)
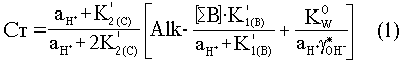
Необходимо знать, что в ходе водного фотосинтеза изменение концентрации ионов CO32- слагается из двух одновременно действующих и противоположно направленных процессов: уменьшением общего количества растворенного неорганического углерода Ст, который расходуется на синтез органических соединений, и увеличением концентрации CO32- в результате подщелачивания среды:
HCO3- + OH- ® CO32- + H2O
Это указывает на существование экстремального пересыщения, выше которого происходит снижение пересыщения при дальнейшем развитии фотосинтеза. Используя уравнение для пересыщения
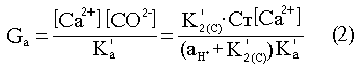
| Alk, M |
[SB], M |
[Ca2+], M |
K'2(C) |
K11(B) |
K0w |
g*OH- |
K'arag |
|
|
20°C |
2,4·10-3 |
4,3·10-4 |
0,01 |
6,59· ·10-10 |
1,9·10-9 |
6,81· ·10-15 |
0,218 |
7,14· ·10-7 |
|
30°C |
2,4·10-3 |
4,3·10-4 |
0,01 |
8,76· ·10-10 |
2,26· ·10-9 |
1,44· ·10-14 |
0,202 |
7,65· ·10-7 |
Табл.5 Расчетные параметры для уравнений (1) и (2),
где [ ] – концентрации; K'a – концентрационное произведение растворимости арагонита, являющегося основной фазой выпадающего из морской воды карбоната кальция – можно рассчитать зависимость пересыщения от pH.
В таблице 5 приведены значения расчетных параметров в уравнениях (1) и (2) для морской воды с соленостью 35%. При температурах 20°C и 30°C, охватывающих интервал поверхностных вод с наиболее интенсивным фотосинтезом. На рис. 3,а представлена кривая снижения концентрации растворенного углерода в системе в ходе фотосинтеза, а на рис. 3,б – зависимость пересыщения от интенсивности фотосинтеза (величины pH).
Как видно из этих рисунков, полного выделения растворенной углекислоты в фотосинтезирующих природных системах не происходит. Максимальное значение пересыщения – 11 – 12 раз по арагониту достигается уже при величинах pH = 9,2 – 9,4, реализуемых в природной обстановке.
Поскольку уравнения зависимости индукционного периода осаждения CaCO3 от пересыщения относятся к условиям морской воды с Ст = 2,33 ммоль/л = const, нельзя считать, что выведенные закономерности напрямую приложимы к условиям фотосинтеза. Дополнительным фактором неопределенности является влияние фосфат-ионов – главных ингибиторов осаждения CaCO3 в природе. Закономерное выведение фосфора из раствора через пищевые цепи организмов может сильно изменить оценку скорости осаждения карбоната кальция.
Были проведены и специальные исследования по изучению кинетики спонтанного осаждения карбоната кальция в условиях, моделирующих фотосинтез в морской воде. В отличие от более ранних экспериментов, в этой работе проводились по два параллельных опыта при индукционных периодах менее 500 минут, что позволило снизить относительную ошибку измерений до 10%. Величины индукционных периодов осаждения определяли визуально или спектрофотометрически. В слабопересыщенных растворах, в силу трудности обнаружения малого количества осадка, основным критерием с начала осаждения было уменьшение pH на заранее заданную величину. Дополнительный контроль карбонатной щелочности, измеренной в нескольких пробах, отфильтрованных через мембранный фильтр после окончания индукционного периода, показал ее заметное уменьшение. Это подтверждает надежность критерия снижения pH в качестве мер индукционного периода. Эксперименты проводили в закрытой ячейке при 20±0,5°C и 30±0,1°C, термостатируемой с помощью водного термостата U15. Во всех опытах использовали искусственную морскую воду соленостью 35%, отфильтрованную сначала через бумажный фильтр, а затем через мебрану 0,45 мм.
Варьирование концентрации общего углерода достигали путем смешивания двух растворов морской воды: без HCO3- и содержащей 10 ммоль/л NaHCO3. Далее в раствор с известной концентрацией общего углерода добавляли несколько капель раствора NaOH до создания величины pH, отвечающей данному Ст в соответствии с уравнением (1) и рис.3. Фосфат вводили в виде точной аликвоты свежеприготовленной морской воды, содержащей 10-5 M PO43-.
Зависимость кинетики осаждения от pH
Поскольку интервал величин pH, достигаемых при фотосинтезе, весьма значителен, возникает вопрос о возможности зависимости кинетики осаждения не только от пересыщения, но и от pH.
Проведены специальные эксперименты при пересыщениях 10, 15 и 20 раз по арагониту в интервале pH = 7,6 – 10,2. Для каждого раствора морской воды с известным содержанием общего углерода (это достигали введением точного количества NaHCO3) добавлением раствора NaOH создавали такое значение pH, которое отвечало желаемому пересыщению. Для получения широкого интервала pH содержание Ст варьировали в 50 раз. Результаты представлены на рис.4. Как видим при pH от 7,7 до 9,8 в интервале протекания процесса фотосинтеза – кинетика осаждения не зависит от pH, но определяется только величиной пересыщения. Наблюдаемое при высоких pH резкое снижение индукционных периодов связано с формированием зародышей уже на стадии создания пересыщения и с возможностью осаждения Mg(OH)2, как это проявлялось визуально в опытах при pH = 10,1-10,2. Это происходило в силу превышения произведения растворимости Mg(OH)2; так, ученый Плэтфорд наблюдал появление осадка Mg(OH)2 при pH = 9,8-9,9. Согласно последним опытам, pH морской воды, равновесной с Mg(OH)2 составляет 9,70.
Моделирование осаждения при фотосинтезе
Используя полученное ранее уравнение зависимости индукционного периода от пересыщения G (при постоянной концентрации Ст = 2,33 ммоль/л)
lg t[мин] = 6,27 - 3,784 lg Ga (3)
Рис.4 Зависимость кинетики осаждения СаСО3 в морской воде от величины рН при постоянном пересыщении (Ст = 0,5 - 50 мМ)
можно по уравнениям (1, 2, 3) рассчитать ожидаемую кривую кинетики осаждения как функции величины pH, достигаемой при фотосинтезе. Из рис.5 видно, что расчетная кривая хорошо согласуется с экспериментальными данными, полученными при переменной концентрации Ст. Причина систематического отклонения опытных точек (пунктирная кривая) в сильнощелочной области при pH > 9,8 аналогична резкому снижению индукционных периодов при G = 10-15 на рис. 4 и, вероятно, связана с возникновением избыточного числа зародышей на стадии создания пересыщения при высоких pH.
Рис.5 Индукционные периоды осаждения CaCO3 в различных условиях фотосинтеза.
Сплошные кривые – расчет по уравнениям (3) – кривая 1, 20°C и (4) кривая 2, 30°C; пунктирные линии – экспериментальные данные.
без перемешивания при 20°C (кривая 3);
то же, с добавлением 3мкгР/л;
с перемешиванием при 30°C.
При 30°C в нормальной морской воде с 2,33 ммоль/л HCO3- было получено
lg t = 6,32 - 3,951 lg Ga (4)
Данные 11 экспериментов хорошо ложатся на прямую, с коэффициентом корреляции 0,994. Используя уравнения 1, 2 и 4, рассчитали ожидаемую кривую кинетики осаждения как функции pH при фотосинтезе до 30°C. Экспериментальные данные обнаружили хорошее согласие до pH < 9,2. Наблюдаемое отклонение в щелочной области связано с теми же причинами, что и при 20°C. Увеличение константы диссоциации воды (см. таблицу 5) в интервале 20–30°C приводит к снижению величины pH момента начала осаждения Mg(OH)2 на 0,3–0,4 единицы.
В неперемешиваемых растворах происходит увеличение длительности индукционных периодов примерно на порядок. Данные эксперименты при 20°C (пунктирная линия) подтверждают это. На рис.5 видно, что в опытах без перемешивания действительно происходит десятикратное уменьшение скорости осаждения.
Роль фосфатов.
Присутствие фосфатов – главных ингибиторов осаждения карбоната кальция – может сильно уменьшить скорость осаждения при фотосинтезе. Вместе с тем известно, что выделение фосфора при интенсивном цветении фитопланктона зачастую приводит к обнаружению аналитического нуля неорганических фосфатов в растворе. Полагая отношение P:C как 1:50 (по весу на сухое вещество в %) или 1:130 в атомных соотношениях, и максимальную начальную концентрацию фосфора 0,1 мг/л, вывели скорость выделения фосфатов в ходе фотосинтеза, используя уравнение (1). Расчеты показали, что уже при pH = 8,5 происходит полное извлечение всех растворенных неорганических фосфатов при 20°C. Это хорошо согласуется с опытами, которые при 25°C используются в уравнении
Ст = 135[PO43-] + 1860 (m моль/л) (5)
Как видно, в этом случае полное исчезновение фосфатов наблюдается при G = 1,86 ммоль/л, то есть pH = 8,55 (рис.3а).
Данные опыты были проведены с морской водой, содержащей 3 мкг/л фосфора (10-7 M[PO43-]), что близко к аналитическому нулю. Как видно из рис.4, не происходит систематических отклонений величин индукционных периодов сравнительно с безфосфатной морской водой. Таким образом, роль фосфатов при осаждении CaCO3 при фотосинтезе незначительна.
Рассматриваемая модель изменения концентрации растворенной углекислоты в ходе повышения pH при фотосинтезе предполагает закрытость системы по отношению к атмосферному резервуару углекислого газа. То есть допускается, что скорость изменения содержания углекислоты в результате фотосинтеза значительно превышает скорость обмена углекислого газа с атмосферой. Это предположение верно, т.к. кинетика взаимодействия с газовой фазой определяется несколькими сутками или неделями, тогда как фотосинтез происходит в течение одного светового дня (12 – 16 часов). Это подтверждается натуральными данными, которые по результатам дневных измерений приводят уравнение связи концентрации общей углекислоты и pH: при 25°C
Ст = -524 pH + 6285 (в mM)
pH = 7,7 - 8,4
На рис. 3а зависимость показана точечной линией.
Видна согласованность с расчетными данными. Отличия обусловлены интегральным характером величины pH, измеряемой в полевых условиях. Используя полученные данные, можно оценить начало выпадения CaCO3 в природных обстановках. Как видно из рис.4 в зонах интенсивного фотосинтеза с температурой поверхностных вод 20–30°C уже при pH = 8,5-8,8 должны создаваться условия, достаточные для гомогенного осаждения CaCO3. В связи с этим следует отметить, что величины pH = 8,5-8,6 (Ga = 5) часто наблюдаются в водах Багамской Банки. Учитывая хорошую локальную перемешиваемость вод (скорость течений достигает 18,5 см/с), которые меняются каждые 6 часов и варьируют по глубине, можно предполагать реальность процесса спонтанной нуклеации. Необходимые индукционные периоды не превышают 1–2 суток. Полученные в работе московских ученых изотопные данные по сравнению состава карбонатов водной взвеси, донных осадков и выделяемых водорослями, изучение гидродинамической обстановки придонных слоев и состава грунтов показывают, что 80–90% карбонатов осаждаются непосредственно из морской воды, а 10–20% имеют происхождение, связанное с жизнедеятельностью фитопланктона. Основываясь на полученных результатах, возможно рассчитать кинетику осаждения CaCO3 в процессе цветения фитопланктона или суточного фотосинтеза водорослевой колонии. Поскольку роль фосфатов ничтожна, а растворенное органическое вещество не оказывает существенного ингибирующего действия, можно использовать данные зависимости индукционного периода от pH при фотосинтезе. Для двух вариантов скоростей процесса 0,2 и 0,5 единиц pH/час – получены кривые зависимости момента выпадения осадка от времени, прошедшего с начала фотосинтеза. Каждой точке зависимости pH(G) от времени соответствует величина индукционного периода появления осадка для данных условий pH и G.(рис.6)
Рис.6 Экспериментальная модель кинетики осаждения CaCO3 при 20°C и различной скорости фотосинтеза.
t – время, прошедшее с момента начала фотосинтеза;
пунктирная правая кривая соотвестствует скорости фотосинтеза 0,5 ед. pH/час;
сплошная 0,2 ед. pH/час;
левые кривые отражают время с начала фотосинтеза до появления первого осадка.
Как видим, минимальное время, требуемое для появления осадка в условиях перемешиваемой среды в ходе фотосинтеза 8 – 12 часов после начала процесса. Гомогенное осаждение при фотосинтезе происходит в условиях переменного пересыщения, т.к. величина G в течение индукционного периода не постоянна. Однако, в силу логарифмической зависимости t от G, этот эффект не может значительно сократить время осаждения даже в условиях очень интенсивного фотосинтеза.
Таким образом, полученные экспериментальные данные дают основания считать, что в условиях интенсивного цветения фитопланктона или в среде водорослевой колонии достигаются пересыщения 10–11 раз по арагониту, и это вполне достаточно для спонтанного осаждения CaCO3. Обычно измеряемые величины pH вблизи фотосинтезирующих организмов являются интегральными характеристиками, поскольку отражают изменения pH в среднем по довольно большому объему раствора. Реальные же пересыщения в тонком приклеточном слое могут достигнуть гораздо больших значений.
Приложение 2
Тематическое планирование по теме “Подгруппа углерода”.
По программе курса химии для 8-11 классов средней общеобразовательной школы разработанной в лаборатории химического образования Института общеобразовательной школы РАО на данную тему отводится 7 часов.
Цели изучения данной темы:
Ознакомить учащихся с характерными свойствами простых и сложных веществ образованных элементами – неметаллами главной подгруппы 4 группы. Сформировать знания о кристаллических решетках, аллотропии, практическом применении веществ на примерах соединений углерода и кремния. Показать роль топлива в развитии экономики страны.
Развивать умения решать качественные задачи, а также расчетные химические задачи: определение массы или объема продукта реакции по известной массе или объему исходного вещества, содержащего примеси.
Расширить представления о взаимосвязи количественных и качественных изменений при сравнении состава и свойств оксидов углерода.
Сформировать знания учащихся по данной теме используя их знания из курсов физики, географии, биологии.
Показать важность взаимосвязей между предметами.
Тематическое планирование в приложении.
Рекомендации по теме “ Подгруппа углерода”
Материал данной темы подвергся довольно значительным сокращениям (всего отводится 7 часов). Не рассматриваются подробно сведения о метане. Однако при изучении химических свойств углерода необходимо обратить внимание учащихся на то, что соединения углерода с водородом весьма многочисленны. В природе смеси углеводородов образуют скопления нефти и природного газа. Это 2 важных вида топлива – сведения из курса географии.
Изучение неметаллов будет завершаться сравнением свойств водородных соединений неметаллов разных групп. Сравнение этих свойств можно провести в такой последовательности: учитель напоминает, какие соединения с водородом могут образовывать различные химические элементы, в каких из этих соединений водород – электроотрицателен, а в каких – электроположителен, каково строение этих соединений и их физические свойства. Внимание учащихся привлекается к тому, какие химические свойства проявляют водородные соединения неметаллов разных групп периодической системы Д.И. Менделеева. Отмечается, что водородные соединения 6-7 групп неметаллов, растворяясь в воде, образуют кислоты, водородные соединения азота и фосфора в тех же условиях обнаруживают основные свойства, а водородные соединения углерода и кремния ни кислотных, ни основных свойств в водном растворе не проявляют. Затем прослеживается, как изменяется сила кислот и оснований, образуемых водородными соединениями неметаллов, при перемещении в подгруппах периодической системы Менделеева сверху вниз и слева направо и даются пояснения этим изменениям. Здесь уже можно привлечь для объяснения закон Кулона, изученный к этому времени в курсе физики.
Рекомендуется также пошаговая подача учебной информации для класса со средним уровнем усвоения материала. Данная система предлагает разъяснения темы небольшими порциями, закрепление каждой с помощью упражнений или в ходе выполнения учащимися самостоятельной работы.
1 шаг – Обратить внимание на то, что химические элементы главной подгруппы 4 группы стоят на границе с металлами. Напомнить, что химические элементы одной и той же подгруппы имеют общее и различное в свойствах, обусловленное их строением. Дается сравнительная характеристика химических элементов подгруппы углерода. Отмечают характер соединений.
2 шаг – Рассматривают свойства простых веществ образованных углеродом. Углерод – один из важнейших химических элементов живых организмов. Изучение аллотропных видоизменений: при характеристике свойств аллотропных видоизменений углерода имеется возможность привлекать знания знания, полученные на других уроках, например: из курса физики об электропроводности графита и использовании его в производстве электродов; из курсов биологии о том, что элемент углерод – основа жизни, он входит в состав белка; из курса географии о месторождениях графита и алмазов, атмосфера и углекислый газ.
3 шаг – Физические свойства углерода, можно изучить в процессе просмотра кинофильма “Углерод” и в ходе работы с раздаточным материалом.
4 шаг – Изучение химических свойств, сопровождающее демонстрацией химических опытов.
5 шаг – На основе изученных свойств делается вывод о применении. Доказывается схема – главная идея химии:

![]()
 свойства
свойства
строение применение
1 шаг – Дедуктивный подход – на основе положения в ПСХЭ, строения атома отсюда структура вещества.
2 шаг – Повторяем материал о аллотропных видоизменениях углерода в связи со строением атома (соединяются атомы ковалентной неполярной связью, образуя простые вещества состава Cn., где n – очень большая временная величина).
3 шаг – Исторический подход – постоянные поиски искусственного способа получения алмаза. Начались в 1881 году – английский ученый Ханней. В СССР осуществлен в 1961 в институте физики высоких давлений по технологии Верещагина. Карбин – состоит из линейных полимеров.
4 шаг – Алмаз, графит, карбин, уголь – родные братья. Различия их физических свойств определяется различной кристаллической решеткой. Химические свойства сходны.
5 шаг – Подчеркивается огромное практическое значение простого вещества.
Экологизация курса химии по теме “Углерод”
Данная программа разработана В.М. Назаренко, МПГУ им. В.И. Ленина. В данной программе более глубоко развиваются МПС, на каждом уроке постоянно привлекаются знания учащихся из других предметов. При изучении этой темы необходимо придерживаться нескольких направлений:
1. Выяснить причины, вызывающие нарушение круговорота углерода в природе.
2. Рассмотреть физико-химическую природу оксидов углерода и оксида кремния.
3. Сравнить возможность их использования живыми организмами в процессе жизнедеятельности.
4. Раскрыть вопросы охраны окружающей природной среды в связи с добычей и использованием ископаемого твердого топлива и производство цемента.
5. Живой мир на планете Земля – это мир углерода, единственный элемент, сохраняющий в цепях одновременно одинарные и кратные связи.
6. Различие от углерода у кремния из-за увеличения заряда ядра и радиуса атома ослабевает связь валентных электронов с ядром, возрастает металличность, уменьшается электроотрицательность. Цепи из атомов кремния неустойчивы.
7. Сформулировать проблему: почему углекислый газ усваивается растениями в процессе фотосинтеза, а оксид кремния IV нет. Ответ на него заключается в следующем: в процессе усвоения растениями углекислого газа лежит реакция карбоксилирования рибулозо-1,5-дифосфата (связывание углекислого газа в темновой фазе фотосинтеза). Эта реакция возможна из-за молекулярной природы углекислого газа (он легко диффундирует через устьица в лист) и из-за наличия в его молекуле двойных связей, при разрыве которых происходит присоединение углекислого газа к углеводу.
В оксиде кремния IV атомы кремния не способны к образованию кратных связей: при образовании химических связей два валентных электрона из четырех переходят на a-подуровень, поэтому с кислородом образуются только одинарные связи. Оставшиеся у кремния и у кислорода неспаренные электроны образуют новые связи с соседними молекулами оксида кремния IV, что приводит к созданию гигантского полимера с атомной кристаллической решеткой, твердого, исключительно плотного инертного вещества, не способного растворяться в воде. В этой форме кремний не усваивается растениями, не включается в обменные процессы и, следовательно, выбывает из круговорота веществ в природе. Но в некоторых формах он участвует в обменных процессах веществ живых организмов. Кремний входит в состав стеблей растений, тканей животных. А искусственно полученные препараты на основе кремния менее канцерогенны, чем на основе углерода, способствуют более эффективному заживлению ран, язв, срастанию костей.
Обсуждая вопрос “Круговорот углерода в природе” следует объяснить, что круговорот состоит из двух циклов:
| геологический | биологический |
|
Представлен углекислым газом, выделяющимися в атмосферу, при сгорании ископаемого топлива, с вулканическими газами, из горячих источников, поверхностных слоев океанических вод, при выветривании горных пород, а также при осаждении карбонатов кальция и магния. Этот цикл очень длителен. |
Цикл короткий и интенсивный: углерод в виде углекислого газа ассимилируется из атмосферы растениями и из биосферы вновь возвращается в геосферу – с растениями углерод попадает в организмы животных и человека, а затем при гниении животных и растительных останков – в почву и в виде углекислого газа в атмосферу. Средняя длительность существования соединений углерода в экосистемах 15 лет. |
Важно отметить главную роль океана, т.к. он адсорбирует из атмосферы примерно 30% углекислого газа, но также служит и его источником, выделяя его в атмосферу в районах теплых вод. Он является “насосом природы”, перекачивая углекислый газ из холодных в теплые районы, т.к. там давление углекислого газа в атмосфере выше (основано на физико-химическом свойстве углекислого газа к растворению в воде, в холодной лучше, чем в теплой). В океанической воде растворено 88% углерода, за 26 дней это количество возвращается в биосферу, остальной оседает в виде карбонатов. Установлено, что углекислого газа в 60 раз больше в водах рек, морей, океанов, чем в атмосфере.
Необходимо указать, что круговорот углерода в природе не замкнут. Углерод выходит из него часто на длительный срок в виде карбонатов, торфа, сапропели, гумуса. Каждый год в атмосферу Земли за счет естественных процессов поступает примерно 0,5Ч109 углекислого газа, тогда как антропогенное его поступление достигло 15-25Ч109 т, что в 100-150 раз больше.
Вместе с учащимися указать главные причины интенсивного притока углекислого газа в атмосферу.
CO2 ® в атмосферу из-за:
1. сжигания ископаемого топлива, отходов целлюлозно-бумажного производства;
2. огромного потребления кислорода металлургической и химической промышленностью;
3. истребления лесов, особенно тропических;
4. разрушения и минерализации лесных подстилок, дернины лугов, степей;
5. осушения болот, сопровождающегося интенсивным окислением торфяников;
6. уничтожения водной растительности в дельтах рек, загрязнения водоемов и морей, приводящего к угнетению фотосинтеза и, как следствие, к увеличению концентрации углекислого газа в атмосфере;
7. обжига известняка, производства цемента.
8. воздействия кислотных дождей на природные запасы карбонатов
CaCO3 + 2H+ ® Ca2+ + CO2 + H2O
Углекислый газ – “парниковый газ” – уменьшает тепловое излучение Земли, но увеличение его концентрации в атмосфере приводит к интенсивному осаждению на дне океана карбонатов кальция и магния, к снижению фотосинтеза (при избытке углекислый газ становится ингибитором этого процесса).
Влияние углекислого газа на человека: наркотическое действие, раздражение кожи, слизистых оболочек, в малых концентрациях возбуждает дыхательный центр, в очень больших – угнетает. Углекислый газ оказывает центральное сосудосуживающее и местное сосудорасширяющее действие, вызывает ацидоз (закисление), повышение содержания адреналина и норадреналина и уменьшение содержания аминокислот в крови, ингибирует действие ферментов в тканях. Животные менее чувствительны к углекислому газу, чем человек.
Наибольшую опасность для здоровья человека представляет оксид углерода II – продукт неполного сгорания топлива. Этот оксид соединяется с гемоглобином крови в 200-300 раз быстрее, чем кислород, образует очень прочное соединение – карбоксигемоглобин, диссоциация которого протекает в 3600 раз медленнее, чем оксигемоглобина (соединение гемоглобина с кислородом). В этом случае резко снижается обеспеченность тканей организма кислородом, развивается гипоксемия.
Оксид углерода II соединяется не только с гемоглобином крови, но и с миоглобином мышц. Он нарушает углеводный обмен, усиливая распад гликогена в печени, нарушая утилизацию глюкозы, повышая уровень сахара в крови, моче и в спинномозговой жидкости, нарушает обмен фосфора и азота, водно-солевой обмен, изменяет содержание витамина B6, повышает содержание липидов в плазме, что способствует усиленному отложению холестерина на стенках сосудов, свертываемость крови и проницаемость сосудов.
Важной проблемой загрязнения атмосферного воздуха является добыча и сжигание твердого топлива.
При сжигании твердого топлива в атмосферу поступает:
1. летучая зола с частицами несгоревшего топлива (2/3 топлива рассеивается в атмосфере) – CO, CO2, SO3, NO2, соединения F;
2. летучая зола с МИ;
3. зола торфа содержит U, Co, Cu, Ni, Pb, Zn.
Причины поступлений:
1. низкий КПД электростанций;
2. неудовлетворительная очистка топочных газов;
3. пыление угля при его добыче и перевозке, потери его при разгрузке и складировании.
Природоохранные меры:
1. предварительное извлечение из топлива серы (путем его гидрирования);
2. применение очистных аппаратов;
3. сокращение территорий, занимаемых ТЭС, путем более компактного их размещения;
4. создание лесозащитных зон.
5. использование шлаков и золоотвалов ТЭЦ в производстве строительных материалов. Другой источник загрязнения атмосферы – производство цемента.
Очаги пыления – барабаны для сушки угля и сырья, шаровые мельницы для угля, сырья и цемента, вращающиеся печи и транспортно-загрузочные установки.
В окрестностях крупного цементного завода П = 400 тыс.т цемента в год на расстоянии 2 км концентрация пыли в воздухе – 20 мг/м3.
Повышенная концентрация кремнезема в воздухе вызывает тяжелое заболевание легких – силикоз. При попадании SiO в дыхательные пути происходит его гидратация в присутствии тканевой жидкости. При этом на поверхности пылевидных частиц образуется коллоидный раствор кремниевой кислоты, которая и становится причиной заболевания: появляется одышка, боли, кашель.
Основные природоохранные меры:
1. полнейшая гирмитизация оборудования;
2. снижение отходов до 99% ;
3. экономное расходование продукции.
(Если на дне вагона останется слой цемента 0,5 см, то потери составят 150 кг).
Элементарный углерод попадает в атмосферу в виде сажи с выбросами. Длительность существования частиц элементарного углерода в атмосфере определяют:
· размеры частиц
· их концентрация
· эффективность механизмов очистки промышленных выбросов
· метеорологические условия (В условиях дождливого климата они могут прибывать в атмосфере до 40 ч, а в засушливом – до одной недели и более.)
Частицы углерода в зависимости от источника загрязнения могут быть покрыты оболочкой, обуславливающей их гидрофильность. Попадая в облака, эти частицы становятся ядрами конденсации. Химические реакции, протекающие на таких частицах, могут приводить к образованию нелетучих веществ из газообразных продуктов, например сульфатов из SO3. Адсорбция частиц углерода аэрозолями снижает прозрачность атмосферы, что уменьшает количество солнечных дней и влияет на климат региона. Частицы угля активно поглощают солнечное излучение, что может привести к парниковому эффекту.
Сажа поступает в атмосферу также в составе обработанных газов автотранспорта. Выхлопы дизельных двигателей, особенно тяжелых грузовиков, состоящие в основном из частиц углерода, дают примерно 1/2 всего количества углеродных частиц, попадающих в атмосферу, крупных городов.
Частицы углерода в составе аэрозолей распространяются очень далеко от индустриальных центров. При открытых разработках угля, подземной его газификации, получение угольного концентрата, сжигание угля на ТЭС в атмосферу выбрасывается, помимо частиц углерода, СО, СО2, соединения серы, хлора, брома, в составе летучих фракций золы – кадмий, Ni, Pb, Se, радионуклеотиды, а также полициклические, ароматические углеводороды.
Высокое содержание частиц углерода в атмосферных аэрозолей ведет к повышению заболеваемости населения особенно страдают верхние дыхательные пути и легкие. Профессиональная заболеваемость представлена в основном антрапозом, пылевым бронхитом; присутствие в угольной пыли частиц SiO2 ускоряет и осложняет этот процесс. Наиболее агрессивны частицы угольной пыли менее 5-7 мкм, способные глубоко проникать в легкие, и в большом количестве задерживаться в легочной ткани. Существенное значение имеет продолжительность воздействия пыли: более длительное при меньшей концентрации оказывает более выраженный эффект, чем менее длительны, но более интенсивное. Повышенное содержание в угле Cu, Fe, Ni, Pb, Zn способствует учащению заболевания антракозом.
Тематическое планирование по теме “Подгруппа углерода”.
|
№ |
тема урока | основные образовательные цели урока | основ-ные понятия (впервые вводимые) | МПС | планируемые результаты обучения | возможные вопросы и задачи с МП уклоном | химический эксперимент |
| 1 |
Положение химич. элементов подгр. углерода в ПСХЭ Д.И.М., строение их атомов. Углерод. Аллотропия углеро да. Адсорбция Хим.св-ва углерода: горение, восст-е оксидов металлов. |
1. Повторить особенности строения атомов Cи Si. 2. Изучить первоначальные представления о природе 4-х валентности C, способности его атомов связываться друг с другом, образуя простые вещества разной структуры, на этой основе учиться прогнозировать св-ва веществ. 3. Изучить на основе структуры угля явление адсорбция. 4. Расширить знания уч-ся о термохимических уравнениях, электроотрицательности, окисл.-восстановит. реакциях на примере хим. св-в углерода. |
адсорбция | природоведение, физика, география |
1) знать св-ва простого вещ-ва угля 2) иметь представление об аллотропных видоизменениях С, адсорбции. 3) уметь сравнивать элементы гл. подгруппы 4 группы, знать строение их атомов, формулы высших оксидов и водородных изменений, их характеристику. 4) уметь составлять уравнения хим. реакций, характеризующих химич. св-ва угля. |
1) Из учебника физики выпишите теплоты сгорания спирта, древесного угля, природного газа. Выразите теплоты сгорания в Дж)/моль. Молярная масса спирта 36 г/моль, древесного угля около 16 г/моль. 2) Из курса физики вспомните: а) что лежит в узлах кристаллической решетки; б) св-ва полупроводников, проводников, изоляторов. 3) Какие аллотропные видоизменения вы помните из курса природоведения? 4) Назовите основные месторождения в России: угля, графита, алмаза. 5) При сгорании в кислороде 1 моль древесного угля выделяется 402 кДж теплоты. Определите: а) количество теплоты Q1, выделяющейся при сгорании 1кг С; б) достаточно ли этой Q для нагревания 1 кг воды от 15 до 25°C (удельная теплоемкость воды 4200 Дж/кг·град) |
§ 28-29, вопросы 3-8 стр. 91, вопросы 1-2 стр. 91. Демонстрации: 1) поглощение С растворенных веществ из газов; 2) восстановление Сu из СuО углем |
| 2 |
Оксид углерода (II) и оксид углерода (IV). Химические св-ва оксида углерода (II): горение восстановление металлов. Химические св-ва окида углерода (IV), взаимодействие с водой и раствором щелочи |
1. Ознакомить уч-ся с оксидом углерода (II) как несолеобразующим оксидом, обладающим св-ми восстановителя; показать значение этого вещ-ва как топлива, отметить его ядовитость. 2. На примере окисления СО повторить условия смещения химического равновесия . 3. Привести в систему знания об оксиде углерода (IV), закрепить умения производить расчеты с применением понятий относительной плотности и молярного объема газа. |
газогенератор, генераторный газ, газификация твердого топлива | природоведение, физика, биология, география |
1) уметь составлять уравнения химических реакций, характеризующих хим. св-ва СО (горение, восстановление металлов из оксидов) и СО2 (взаимодействие с водой, раствором щелочи) 2) сравнивать по химическим свойствам СО и СО2 3) разъяснить процессы, происходящие в газогенераторе 4) знать требования по охране окружающей Среды |
1) Вспомните сущность процесса фотосинтеза. 2) Расскажите об обмене газов СО2 и О2 в легких и тканях. 3) Составьте диаграмму влияния давления и температуры на растворимость СО2. 4) Расскажите об отрицательном воздействии СО на организм человека. 5) Глобальная проблема человечества “Парниковый эффект” - что это? 6) На сколько граммов масса 5,6 л СО2 больше, чем масса 5,6 л оксида углерода (II). |
§ 30, § 31, стр. 83-86, задание 1, стр. 92. Демонстрация: получение оксида углерода(IV) и взаимодействие его с водой и раствором щелочи. |
| 3 | Угольная кислота, общие св-ва карбонатов. Качественная реакция на карбонат - ион. Превращение карбонатов в природе. Круговород углерода в природе. |
1) ознакомить с особенностями свойств угольной кислоты и карбонатов; 2) повторить явление гидролиза. 3). Понятие о кислой соли, о превпащениях кислых солей в нормальные и обратно. 4). Научить распознавать карбонат - ион в соединениях. |
карбонат-ион | биология, география |
1. знать качественную реакцию на карбонат-ион 2. уметь составлять уравнения реакций, характеризующие превращения карбонат в гидрокарбонат. |
а) почему иногда пьют раствор питьевой соды? б) изобразите схему круговорота углерода в природе в). Предположите, как происходит процесс образования карбонатов в мировом океане. г). Вспомните, определение ион. д). Почему известняк в размолотом виде применяют для уменьшения кислотности почв? |
§ 32, 33, 34, задачи 2-5, стр.92. Лабораторный опыт № 7. |
| 4 |
Решение расчетных задач на определение массы или объема продукта реакции по известной массе или объему исходного вещества содержащего примеси. |
Научить решать задачи. | Примеси. |
Уметь решать задачи, вычисляя массы (объем) продуктов реакций по указанным массе, объему исходных веществ, одно из которых содеожит примеси. |
Уметь решать задачи, вычисляя массы (объем) продуктов реакций по указанным массе, объему исходных веществ, одно из которых содеожит примеси. |
Подготовка к практической работе. | |
| 5 | Получение оксида углерода (4) и изучение его свойств. Распознавание карбонатов. |
1). Научить собирать прибор для получения газов. 2). Изучить свойства углекислого газа. 3). Провести распознавание карбонатов. |
С природоведением, географией, биологией. |
1). Уметь собирать прибор для получения газа,который тяжелее воздуха. 2). Получить в нем углекислый газ, и подтвердить его наличие. 3). Распознавать карбонаты с помщью качественной реакции на карбонат - ион. |
1). Назовите основных поставщиков углекислого газа в природу. 2). Основые минералы карбонаты, их назначение и название. |
Практическое занятие № 5. | |
| 6 | Краткие сведения о кремнии и его соединениях. |
1). Изучить свойства кремния, его оксида и кислоты по аналогии с углеродом и его соединениями. 2). Убедиться в том, что свойства - следствие строения веществ. |
Силицид. | Природоведение. |
1). Уметь составлять уравнения химических реакций, характеризующих свойства кремния и его соединений: оксида кремния,кремниевой кислоты, силикатов. 2). Разъяснить свойства оксида кремния и кремниевой кислоты. |
1). Назовите самое распостраненное полезное ископаемое, отвечающее формуле SiO2? 2). Назовите известные вам минералы в состав которых входит кремний. |
Лабораторный опыт № 8. Ознакомление с образцами природных силикатов. Параграфы 35, 36, 37, 38, страницы 92-97. |
| 7 | Строительные материалы: стекло, цемент, бетон; их получение в промышленности. |
1). Ознакомиться с основными продуктами силикатной промышленности (стеклом. керамикой); с реакциями, лежащими в основе получения стекла. 2). Узнать о местных производствах силикатной промышленности. |
Природоведение. |
1). Уметь характеризовать свойства строительных материалов. 2). Перспективы развития силикатной промышленности. |
1). Вспомнить из курса природоведения, сырье для керамических изделий: фарфора, фаянса, (охарактеризуйте свойства сырья). 2). Что служит сырьем для получения стекла? 3). Охарактеризуйте свойства стекла. |
Параграф 39, страницы 97-100, з.1-2, стр.101. Демонстрации: виды стекла, затвердевание цемента при смешении с водой. Лабораторный опыт № 9. |
Приложение 3
Межпредметный семинар “Биогенные элементы в
периодической системе Д.И. Менделеева”.
Наиболее эффективным средством обучения является семинар. Межпредметный семинар – одна из эффективных форм организации учебной работы, которая способствует обобщению знаний учащихся из разных предметов. Такой семинар позволит в целом комплексе решать задачи образования, развития и воспитания школьников, то есть ТДЦ.
Межпредметный семинар “Биогенные элементы в ПСХЭ“ – проводится как завершающий и обобщающий тему “ПЗ и ПС Д.И. Менделеева“, “Строение вещества”. Данный семинар проводится с учетом особенностей строения атомов биогенных элементов и их роли в живых организмах и проводится на факультативных занятиях по химии при изучении строения вещества.
Основная цель семинара установить закономерные связи между строением атома, химическими свойствами и биогенными функциями элементов.
За две недели до семинара предлагаем учащимся вопросы для подготовки, называем параграфы из учебников химии и биологии, которые необходимо повторить, рекомендуем дополнительную литературу. Учитель биологии проводит семинары-консультации, на которых рассматриваются более сложные вопросы биологического характера. В процессе совместной работы учителей и коллективной деятельности учащихся, знания по химии и биологии о биогенных элементах приводились в систему.
Учителя-методисты отмечают, что эффективность межпредметных семинаров значительно повышается, если использовать проблемный подход в обучении, коллективную работу в классе и индивидуальный подход к учащимся. Методика семинара в отличии от конференций, в центре которых стоят доклады учащихся, предполагает, прежде всего, совместное обсуждение общей проблемы, темы семинара, а также активность всех учеников в достижении основной учебной цели. Поэтому используются многообразные средства активизации познавательной деятельности учащихся на основе проблемного подхода. Занятия семинара строились таким образом, что учащиеся должны были решить ряд последовательно предложенных проблемных (межпредметных) вопросов: почему именно элемент углерод, а не кремний является основным элементом жизни? Как объяснить, почему с повышением в крови концентрации диоксида углерода повышается и концентрация ионов H+? Какова их физиологическая роль? Почему жизнь зародилась в воде и как это произошло? Каковы физико-химические свойства воды и как объяснить ее биологические функции? Почему живые организмы дышат кислородом, хотя в атмосфере значительно больше азота? Содержание данных вопросов предполагает одновременное использование и обобщение знаний из курсов химии и биологии.
В процессе коллективной беседы учащиеся высказывают предположения, ищут их обоснование и приход к решению поставленных проблем.
На межпредметных семинарах нередко заслушиваются доклады учащихся. Тематику докладов целесообразно посвящать вопросам, которые еще не изучались в курсах химии и биологии и требуют самостоятельного освоения учащимися новых разделов учебных программ (например: значение углерода для организма человека); не входят в школьные программы и требуют самостоятельного изучения из дополнительной литературы (например: “Использование элементов-органогенов в медицине”).
Распределение докладов проводилось с учетом познавательных интересов учащихся и их возможностей. В процессе семинара сообщения учащихся прерывались беседой и обобщениями учителя. Доклады служат опорой в постановке и решении проблемных межпредметных вопросов.
Рассмотрим на примере, как происходит на семинаре решение ряда предложенных (межпредметных) проблемных вопросов. Во вводной части семинара в процессе беседы учащиеся повторяют химический состав живых организмов, выводится понятие о биогенных элементах как элементах, из которых строятся органические и неорганические вещества живых организмов, обеспечивающие их основные функции. Рассматриваются и записываются в тетрадь сведения о положении этих элементов в ПС.
Отмечается, что углерод, водород, кислород, азот – это широко распространенные элементы. Они находятся в двух первых периодах таблицы Д.И. Менделеева, имеют небольшой порядковый номер и обладают высокой способностью к образованию устойчивых ковалентных полярных связей в молекулах белков, жиров, углеводов.
Учитель, подчеркивает, что основной скелет органических соединений, входящих в состав живых организмов, образуется из атомов углерода. Перед учащимися ставится проблемный вопрос: почему именно элемент углерод, а не кремний является основным элементом жизни, хотя эти элементы в таблице находятся в одной группе и имеют сходное строение атом?
Учащиеся по заранее подготовленной таблице “Углерод и кремний“ сравнивают строение атомов, химические свойства элементов. Учитель подчеркивает, что углерод имеет строение атома, промежуточное между металлами и неметаллами, поэтому он легко вступает в реакцию со многими элементами, в том числе и с водородом, кислородом, азотом, образуя разнообразные органические вещества. Главной особенностью атомов углерода является их способность к образованию простых элементных связей друг с другом. Это ведет к созданию длинных углеродных цепей (-C-C-C-), прямых, разветвленных, в виде колец, спиралей (демонстрируются таблицы сложных органических веществ), что приводит к огромному многообразию соединений. В большинстве источников – 5-6 млн органических веществ, по сведениям иностранных журналов – 12 млн. Вследствие большой металличности, меньшей электроотрицательности кремния по сравнению с углеродом атомы кремния не образуют длинных цепей.
Сравнение связей -C-C- и -Si-Si- показывает, что расстояние между атомами углерода значительно меньше, чем между атомами кремния. Это обеспечивает устойчивость углеродных связей и наличие в них большего запаса энергии, что важно для биоэнергетического обмена, для жизнедеятельности организма. Запасы энергии в органических соединениях увеличиваются благодаря способности атомов углерода создавать устойчивые при обычных условиях длинные цепи.
Совместно с учащимися делается вывод о необходимости для жизни организмов макромолекул органических веществ с большим числом химических связей, с большим запасом внутренней энергии. Такие макромолекулы образует углерод. Учитель обобщает результаты коллективного обсуждения вопроса: мир углерода – это живая природа, мир кремния – неживая природа.
Рассмотрим это на примере фотосинтеза.
Мы утверждаем, что мир углерода – это живая природа. Наиболее яркое и знакомое из курса биологии 6-7 класса учащимся такое явление как фотосинтез. Изобразив схему фотосинтеза, нетрудными вопросами вспоминаем: 1) Из каких веществ образуется сахар в зеленых листьях растений? 2) Какой опыт показывает, что наземные растения на свету поглощают CO2 и выделяют кислород? (рис. 1)
Используя знания физики-9 о втором законе термодинамики повторяем, что любые виды энергии в конечном счете превращаются в тепловую форму и рассеиваются. Реакция же фотосинтеза сопровождается накоплением энергии в органическом веществе за счет преобразования энергии фотонов в энергию химических связей.
Энергетический смысл фотосинтеза заключается в расщеплении светом некоторого донора водорода DH2 и переносе водорода на акцептор A с выделением свободного окислителя D:
DH2 + A ®свет AH2 + D
В качестве акцептора выступает углекислый газ, а роль донора водорода могут играть некоторые органические соединения, сероводород и вода.
Наибольшее распространение получил процесс с участием воды, идущий в зеленых растениях:
6 CO2 + 6 H2O + 673 ккал хлорофилл® (СH2O)6 + 6 O 2
При этом источником кислорода является вода, а не углекислый газ. В некоторых случаях синтез органического вещества может осуществляться некоторыми бактериями без выделения кислорода. Источником углерода для них служит углекислый газ, а водород берется из сероводорода (или какого-либо органического соединения):
6 CO2 + 12 H2S ® (CH2O)6 + 12 S + 6 H2O
Фотосинтез – это сложная многостадийная реакция:
1 стадия – световая – молекулы хлорофилла возбуждаются фотонами света с длиной волны 670-680 нм и ускоряют фотолиз воды, то есть разложение воды на кислород, который поступает в атмосферу, протоны и электроны:
H2O ® 2 H+ + 2 e- + 1/2 O2
Энергия, образующихся электронов используется в последующих реакциях с участием пигментных фотосистем растений.
2 стадия – темновая, так как протекает без участия солнечного света, во время которой происходит поглощение CO2 и синтез на его основе органических веществ – сахаров, глицерина и аминокислот.
Этот процесс, возникнув на Земле, стал мощным геологическим фактором (весь кислород атмосферы имеет фотосинтетическое происхождение).
Ежегодно запасаемое растениями в продуктах фотосинтеза общее количество энергии составляет примерно 1024 ккал. Хотя коэффициент полезного действия фотосинтеза невелик (КПД из курса физики).
Известно, что хлорофилл поглощает энергию, находящуюся в голубой (400-500 нм) и красной (610-690 нм) областях спектра.
Поэтому в реальных условиях лишь 10% энергии из видимой области спектра, получаемой растениями, действительно обращается в биомассу. Если сопоставить количество энергии, преобразованной в органические вещества растениями, с большим количеством солнечной энергии, достигающей поверхности Земли, то коэффициент полезного действия фотосинтеза оказывается крайне низким (менее 1%). Только в редких случаях, касающихся культурных растений с высокой продуктивностью, можно повысить КПД до 3% .
Роль образующей глюкозы велика, так как в дальнейшем процессе фотосинтеза образуется крахмал – является запасным питательным материалом для растений и содержится в них в виде крахмальных зерен.
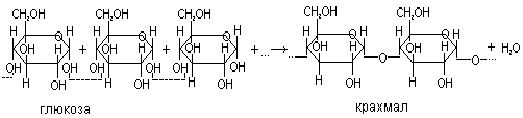
Существенное отличие химии кремния от химии углерода обусловлено прежде всего относительно малой прочностью связей Si-Si. Поэтому цепочки из атомов кремния разрываются гораздо легче , чем углеродные, особенно если имеется возможность образования наиболее характерной для кремния связи с кислородом. Прямым следствием является резкое уменьшение числа устойчивых кремниевых соединений по сравнению с углеродными. Так, различных минералов известно около 3 тыс., а отдельных видов живых организмов описано более миллиона.
Сравнение диоксида углерода и диоксида кремния показывает активное участие соединений углерода в круговороте веществ в природе, в реакциях обмена веществ в организме (например, газообмен в легких и тканях).
Обмен газов в легких
Содержание газов во вдыхаемом и выдыхаемом воздухе неодинаково. Во вдыхаемом воздухе содержится почти 21% кислорода, около 79% азота, примерно 0,035% , небольшое количество водяных паров и инертных газов.
Процентный состав выдыхаемого воздуха иной. Кислорода в ней остается около 16%, количество углекислого газа возрастает до 4%. Увеличивается и содержание водяных паров. Азот и инертные газы в выдыхаемом воздухе остаются в том же количестве, что и во вдыхаемом. Разное содержание кислорода и углекислого газа во вдыхаемом и выдыхаемом воздухе объясняется обменом газов в легочных пузырьках. Концентрация углекислого газа в венозных капиллярах легочных пузырьков гораздо выше, чем в воздухе, заполняющем легочные пузырьки. (рис. 2)
Углекислый газ из венозной крови поступает в легочные пузырьки и во время выдоха выводится из организма. кислород из легочных пузырьков проникает в кровь и вступает в химическое соединение с гемоглобином. Кровь из венозной превращается в артериальную.
По легочным венам артериальная кровь поступает в левое предсердие, затем в левый желудочек и в большой круг кровообращения.
Обмен газов в тканях
Из капилляров большого круга кровообращения кислород поступает в ткани. (рис.3). В артериальной крови кислорода больше, чем в клетках, поэтому он легко диффундирует в них и используется в окислительных процессах. Углекислый газ из клеток поступает в кровь. Таким образом, в тканях органов происходит превращение артериальной крови в венозную.
Венозная кровь по венам большого круга кровообращения поступает в правое предсердие, затем в правый желудочек сердца, а оттуда в легкие.
Учитель знакомит учащихся с тем фактором, что при повышении в крови концентрации диоксида углерода повышается и концентрация ионов водорода. Ставиться новый проблемный вопрос: почему с повышением в крови концентрации диоксида углерода повышается и концентрация ионов водорода? Как это объяснить?
Учащиеся записывают уравнение реакции:
CO2 + H2O ® H2CO3 ® H+ + HCO3-
Далее повторяется строение атома водорода, особенности его положения в ПС, образование ионов водорода:
H - 1 e- ® H+; H + 1 e- ® H-
Отмечается, что при отдаче электрона от атома водорода остается один “голый протон”, радиус которого почти в 2000 раз меньше радиуса атома водорода. Физиологическое значение положительного иона водорода, рассказывается в докладе ученика, который готовил его, консультируясь с учителем биологии.
Аналогично, путем бесед, докладов и самостоятельной работы учащихся с обобщающими таблицами и периодической системой элементов, проходит обсуждение всех других вопросов семинара.
В заключение учащиеся подводят к мировоззренческому выводу о наличии в природе связей “строение – свойства – функции”: биологические (физиологические) функции всех биогенных элементов определяются их физико-химическими свойствами, которые, в свою очередь, зависят от особенностей строения их атомов, их места в ПСХЭ Д.И. Менделеева. В этом проявляется материальное единство живой и неживой природы.
В целях создания межпредметных связей учащимся предлагается дома заполнить таблицу “Знания по биологии, химии, физике, которые привлекались на семинаре”.
| предмет | знания (понятия, законы, факты) |
Об эффективности межпредметного семинара можно судить по количеству высоких оценок, по росту интереса к познанию взаимосвязей наук химии, биологии. Межпредметный семинар имеет большое воспитательное и образовательное значение.
Вопросы межпредметного семинара.
| вопросы семинара | вопросы для подготовки | литература |
| 1. Углерод – основной элемент жизни. Сравнение элементов углерода и кремния. |
1. Понятие об элементах – органогенах. 2. Строение атомов и сравнительная характеристика элементов углерода и кремния. 3. Способность атома углерода к образованию химических связей и углеродных цепей. |
Химический состав клетки и ее жизненные свойства. Учебник “Человек”, § 3. Характеристика элемента по его положению в ПТ и строению атома. Учебник “Неорганическая химия”, 8 кл. |
| 2. Водород, его роль в образовании органических веществ. |
1. Особенности строения атома водорода. Отсутствие аналогов. 2. Образование связи водорода с углеродом. 3. Ион водорода и его значение в физиологических процессах. |
Состояние электронных оболочек атомов. Состояние электронов в атомах. Ионная связь. Ковалентная связь. Учебник “Неорганическая химия”. |
| 3. Вода. Ее значение в жизни организмов. |
1. Строение молекулы воды. 2. Физические свойства воды. Вода как растворитель. 3. Значение воды в жизни организмов. |
Вода как растворитель. Растворимость. Значение растворов в природе. Ковалентная связь. Учебник “Неорганическая химия”. 8-9 кл. Водный обмен. Учебник “Человек”, 9 кл. |
| 4. Элементы кислород и азот. Их сходство с углеродом и отличие. Дыхание и фотосинтез. Круговорот углерода в природе. |
1. Строение атомов кислорода и азота. Полярность связи. 2. Строение молекул кислорода и азота. Энергия химических связей. 3. Дыхание и фотосинтез как ox-red процессы. 4. Обмен веществ и энергии. |
Ковалентная связь. ox-red реакции. Учебник “Неорганическая химия”. 9 кл. “Поглощение листьями на свету углекислого газа и выделение кислорода. Поглощение азота из воздуха”. Учебник “Ботаника”, 6-7 кл. Значение дыхания. Газообмен в легких и тканях. Ассимиляция и диссимиляция. Учебник “Человек”. |
| 5. Элементы фосфор, азот, сера. Их участие в образовании органических веществ и в энергетическом обмене. |
1. Многообразие аминокислот и белков. 2. Значение фосфора, азота и серы для живого организма. |
Многообразие белков и их образование в клетках. Учебник “Человек”. |
| 6. Использование элементов – органогенов в медицине. |
1. Физиологический раствор. 2. Соединения кальция, железа в медицине. 3. Применение кислорода в медицине. |
Сероводород. Учебник “Неорганическая химия”, 9 кл. Популярная медицинская энциклопедия. |
Круговорот углерода
Круговорот углерода (CO2) такой же важный цикл для биосферы, как и круговороты H2O и O2. В круговороте углерода атмосферный фонд очень невелик по сравнению с запасами углерода в океанах, в ископаемом топливе. Полагают, что до наступления индустриальной эры потоки углерода между атмосферой, материками и океаном были сбалансированы, но в последние 100 лет содержание углекислого газа в атмосфере постепенно растет в результате новых антропогенных поступлений. Считают сжигание горючих ископаемых, интенсивное развитие с/х и уничтожение лесов.
Перед учащимися может возникнуть проблема: каким образом с/х связано с увеличением содержания углекислого газа в атмосфере, если известно, что зеленые растения в процессе жизнедеятельности фиксируют этот газ?
В ходе обсуждения, привлекая знания из биологии, учащиеся могут прийти к выводу, что фиксация углекислого газа с/х культурами (многие из которых активны лишь часть года) не компенсирует количество углекислого газа, высвобождающего из почвы, особенно при ее частой вспашке.
Вторая причина может возникнуть при обсуждении причин и последствий увеличения углекислого газа в атмосфере в результате сжигания горючих ископаемых, поскольку известно, что фотосинтезирующий “зеленый пояс” Земли и карбонатная система моря поддерживают постоянный уровень содержания углекислого газа в атмосфере (образование углекислого газа компенсируется потреблением его растениями, а также превращением в карбонаты). Каковы же причины и последствия нарушения этого равновесия?
Можно указать четыре причины:
1. Стремительное возрастание потребления горючих ископаемых.
2. Уменьшение поглотительной способности “зеленого пояса”.
3. Загрязнение поверхности Мирового океана.
4. Загрязнение атмосферы.
Что же касается последствий, то это парниковый эффект. Если в атмосфере установится равновесие между углекислым газом, не пропускающим поступающие на Землю лучи, то любое значительное изменение в тепловом балансе повлияет на климат планеты.
В круговорот углерода оба вещества вовлекаются в виде углекислого газа, до которого они окисляются.
Схема круговорота углерода в главе 2.
Приложение 4
Викторина “Знаете ли вы химию и географию?”
Данный турнир лучше проводить в виде телеигры “Счастливый случай” между параллельными классами для 9х.
Игра состоит из трех туров:
I тур. Учитель поочередно задает вопросы командам (номер вопроса по вытянутому жетону). На обдумывание вопроса дается 15 секунд. Вопрос, на который не дан ответ, задается болельщикам.
II тур. “Ты – мне, я – тебе”. Каждый из команды задает противнику вопрос. Отвечающий не может советоваться. Время – 15 секунд.
III тур. “Дальше. Дальше. Дальше.” За 2 минуты команда должна ответить на как можно больше вопросов, то есть конкурс на быстроту, точность. За каждый правильный ответ – 1 очко. Побеждает тот, кто набирает больше очков.
Вопросы:
1. Какие химические элементы названы в честь частей света? 2. Перечислите элементы, названные в честь стран. 3. Названия каких химических элементов произошли от названий столиц европейских государств? 4. Какой химический элемент назван по имени острова? 5. Название какого элемента произошло от названия полуострова? 6. Какие химические элементы названы в честь: а) города в США, б) штата США. 7. Какой химический элемент получил свое имя по названию города в Древней Греции? 8. Название какой шведской деревушки дало имя четырем химическим элементам? Назовите эти элементы. 9. Какой химический элемент назван в честь провинции в Германии? 10. Верно ли утверждение, что индий назван в честь Индии? 11. Какой элемент второй группы получил свое имя по названию деревни в Шотландии? 12. Почему тулий (№ 69) получил такое название? 13. В названия каких химических элементов входят названия рек? 14. Добавьте к названию элемента две буквы в конце слова и назовите реку, берущую свое начало в Монголии и впадающую в Байкал. 15. Заменив одну букву в названии химического элемента, получите название реки во Франции, заменив же другую – название реки, на берегах которой стоит Пенза. 16. Поменяйте окончание “-ий” в названии элемента на “-а”, получите старое название города на Волге. 17. Отбросьте первую букву в названии химического элемента восьмой группы и получите название притока Днестра. 18. Поменяйте букву в названии благородного газа и получите имя реки и города на ней в Чечено-Ингушетии. 19. Замените первую букву в названии химического элемента и получите название пролива между Европой и Азией. 20. Замените первую букву в названии элемента семейства актиноидов и получите название государства в Азии. 21. Замените две буквы в середине названия химического элемента и получите название мыса на юге Сахалина. 22. В названии какого химического элемента содержится название озера в Турции? 23. Назовите химические элементы, которые носят одинаковые названия с городами в СНГ. 24. Какие населенные пункты СНГ имеют названия, связанные с названием химических элементов? 25. Замените последнюю букву в названии элемента на две одинаковые, получите название столицы республики СНГ. 26. Переставьте местами две первые буквы в названии химического элемента, получите город во Франции, расположенном на берегу Сены. 27. Переставьте местами буквы в названии элемента подгруппы железа и получите название города в Куйбышевской области. 28. Прибавьте к названию химического элемента название музыкальной ноты, получите название города во Франции. 29. Замените окончание “-ий” в названии элемента на “а”, получите название города-героя. 30. В названии каких двух химических элементов входит название крупного города в Колумбии? 31. Отбросьте последнюю букву в названии элемента второй группы, получите название итальянского порта на Адриатическом море. 32. Замените последнюю букву в названии элемента и получите название портового города Ростовской области. 33. Название какого острова в Беринговом море связано с названием химического элемента? 34. Отбросив первую букву в названии радиоактивного элемента, получите название острова в Малой Курильской гряде. 35. Добавив к названию элемента шестой группы одну букву, получите название моря и одноименного острова в составе Молуккских островов в Индонезии. 36. Заменив последнюю букву в названии химического элемента, получите название горной системы, являющейся границей между Европой и Азией. 37. Где находятся: а) Золотой Рог, б) Золотые ворота, в) Золотые пески, г) Серебряный берег, д) Железные ворота?
Ответы:
1. Европий, америций, 2. Германий, франций, полоний (Польша), рутений (Россия), галий (Франция). 3. Гольмий (от старого названия Стокгольма), лютеций (от старого названия Парижа), гафний (старое название Копенгагена). 4. Медь (остров Кипр (Сиргит)), 5. Скандий (Скандинавский п-ов). 6. а) Берклий (Беркли); б) Калифорний (Калифорния). 7. Магний (Магнисия). 8. Иттерби, иттрий, тербий, эрбий, иттербий. 9. Гений (Гейнская провинция). 10. Индий – от синей (индиговой) линии в спектре этого элемента. 11. Стронций (Стронишан). 12. Тулий (от греч. слова “туле” – античные географы называли самую северную часть Земли – северная часть Скандинавского полуострова). 13. Радон – Дон; нильсборий – Нил; индий – Инд; полоний – По. 14. Селен – Селенга. 15. Сера – Сена – Сура. 16. Самарий – Самара. 17. Никель – Икель. 18. Аргон –Аргун. 19. Фосфор – Босфор. 20. Уран – Иран. 21. Криптон – Крилеон. 22. Ванадий – Ван. 23. Никель (Мурманская обл.), Марганец (Днепропетровская обл.), Бор (Нижне-Новгородская обл.) 24. Железноводск (Ставропольский край); Железногорк (Курская обл.), Железногорск-Илимский (Иркутская обл.); Железное (Северо-Казахстанская обл.); Золотаревка (Пензенская обл.); Золотая гора (Амурская обл.); Золотники (Тернопольская обл.); Золотое (Луганская обл.); Медногорск (Оренбургская обл.); Медное (Калининская или Тверская обл.); Сереброполь (Алтайский край); Хромтау (Актюбинская обл.); Оловянная (Читинская обл.); Никельтау (Актюбинская обл.); 25. Таллий – Таллинн; 26. Уран – Руан; 27. Никель – Кинель; 28. Бор – Бордо; 29. Тулий –Тула; 30. Калий, калифорний – кали; 31. Барий – Бари; 32. Азот – Азов; 33. Медный; 34. Кюрий – Юрий; 35. Сера – Серам; 36. Уран – Урал; 37. а) бухта в проливе Босфор, залив Петра Великого у Владивостока; б) пролив, соединяющий Сан-Франциско с Тихим океаном; в) курорт Болгарии на Черном море; г) побережье Бискайского залива во Франции; д) теснина на реке Дунай на границе Югославии и Румынии.
Приложение 5
Межпредметная конференция по экологии
Данная конференция в традиционной форме по плану:
1. Вступительное слово ведущего.
2. Доклады: “Парниковый эффект”, “Разрушение слоя озона атмосферы”, “Кислотные осадки”, “Фотохимический смог”.
3. Обсуждение докладов.
4. Подведение итогов конференции.
Ведущий: Сегодня одни из самых тревожных слов – “экологическая катастрофа”. Ежедневно мы слышим предостережения: “Образумтесь, люди!”, “Будущее земли в опасности!”, “На нас – ответственность перед настоящим и будущим!”. Но все они так и останутся лишь призывами, благими намерениями, если мы не осознаем главного: человечество стоит на пороге экологической катастрофы. Здесь нет преувеличений. Эта тревога так серьезна, что настоящей проблемой по охране окружающей среды занимаются интенсивно не только экологи, но и химики, физики, биологи, метеорологи. Задача сохранения Земли, пригодной для обитания человека и всех других организмов, не может быть решена без сотрудничества всех стран и всех народов Земли, а также без повышения экологической культуры каждого человека.
В последние годы жизни человека угрожают “парниковый эффект”, озоновая “дыра”, кислотные дожди и фотохимический смог. Наша конференция посвящена раскрытию сущности этих явлений.
1-ый ученик. “Парниковый эффект”.
Некоторые газы, составляющие незначительную долю атмосферы, подобно стеклянной крыше парника хорошо пропускают солнечную радиацию, но задерживают уходящее длинноволновое тепловое излучение Земли. К ним относятся диоксид углерода, метан, оксид азота, хлорфторуглероды. Поскольку в этом отношении они подобны стеклянной крыше парника, их часто называют парниковыми газами.
Несмотря на то, что суммарное содержание парниковых газов в атмосфере очень мало, увеличение концентрации хотя бы одного из них приводит к тому, что в атмосфере начинает задерживаться больше тепла, в результате чего повышается средняя температура атмосферы Земли и ее поверхности. Повышение температуры внутренних слоев атмосферы и поверхности Земли, обусловленное накоплением в атмосфере парниковых газов, называется парниковым эффектом. Последние данные показывают, что поступление и накопление в атмосфере диоксида углерода и метана, обусловленное хозяйственной деятельностью человека приводит к потеплению климата Земли. В результате парникового эффекта год за годом на нашей планете становиться теплее, климатические зоны смешиваются, ледники тают, уровень моря увеличивается.
Для замедления начавшегося потепления климата необходимо, прежде всего, остановить избыточное поступление парниковых газов в атмосферу.
2-ой ученик. “Разрушение слоя озона атмосферы. Озоновая “дыра”.”
Стратосферный озон O3 образуется, когда молекула кислорода, поглощая коротковолновую радиацию Солнца, распадается на два атома кислорода, каждый из этих атомов соединяется с другой молекулой кислорода, образуя молекулу озона.
Озон легко поглощает ультрафиолет и распадается на первоначальные компоненты O2 и O. Освободившийся атом кислорода вновь соединяется с молекулой кислорода и образует молекулу озона. При низменных условиях скорость образования озона равна скорости его распада.
Содержание озона в атмосфере не достигает и одной миллионной доли от содержания остальных газов, однако именно озон поглощает большую часть солнечной ультрафиолетовой радиации, не давая ей достигнуть земной поверхности. Если снижение земной концентрации озона вблизи поверхности Земли оказало бы оздоравливающее влияние на загрязненные местности, то снижение концентрации стратосферного озона опасно, поскольку следующее за этим увеличение интенсивности ультрафиолетового излучения, достигающего поверхности, влечет за собой много неприятных последствий. Оно повышает частоту раковых заболеваний кожи и катаракты, повреждает сельскохозяйственные культуры и разрушает фитопланктон – микроскопические растения, являющиеся начальным звеном пищевой цепи в океане.
Главными виновниками снижения концентрации озона в атмосфере являются хлорфторуглероды, в особенности CFCl3 и CF2Cl2. Атомы хлора, входящие в состав хлорфторуглеродов, выбрасываемых в атмосферу, разрушают слой озона.
Озонная “дыра” – это область резко пониженной концентрации озона в стратосфере. Она в более очевидной форме наблюдается над Антарктикой, где в последнее десятилетие весеннее содержание озона снизилось на 50%. В Антарктике и, в какой-то степени, Арктике низкие температуры способствуют ускорению процессов, разрушающих слой озона.
Выводы о состоянии слоя озона в целом по земному шару пока еще делать рано, но уже сейчас можно сказать о том, что за последние 20 лет зимой и ранней весной в средних и высоких широтах Северного полушария потери озона составляют от 3 до 10%, причем большие потери отмечались в высоких широтах.
3-ий ученик “Кислотные дожди”.
“Кислотные дожди” (к которым относятся также кислотные снега, туман и роса) являются в основном побочным продуктом химической реакции в атмосфере. Их может быть несколько, в которых участвуют оксиды азота и диоксид серы. В ходе различных реакций, таких, как соединения с водой, эти газы могут превращаться соответственно в азотную и серную кислоту, которые хорошо растворимы в воде. Капельки такого раствора, падающие на Землю, и представляют собой “кислотный” дождь.
Источником оксидов серы и азота являются теплоэлектростанции, нефтеперерабатывающие и металлургические заводы, транспорт и т.д.
“Кислотные” дожди наносят колоссальный ущерб здоровью людей и материальным средствам. Под их влиянием гибнут озера вместе со своими обитателями, корродирует почва, массивы лесов превращаются в мертвые леса. “Кислотные” дожди разъедают не только легкие человека, но и камни, металлы, краски.
4-ый ученик “Фотохимический смог”.
Неприятным явлением в современных городах и их окрестностях является фотохимический смог. Этим термином обозначают смесь газов, образующуюся в нижних слоях атмосферы, где солнечная радиация воздействует на некоторые газы (особенно на оксиды азота и углеводороды, содержащиеся в выхлопах автомобилей), в результате образуются газы с высокой реакционной способностью, очень вредные для живых организмов.
Главным продуктом таких фотохимических реакций является озон, который в основном и воздействует на глаза и легкие и наносит вред деревьям и сельскохозяйственным культурам. Именно “густоту” смога обычно выражают через концентрацию озона на уровне земной поверхности.
При проведении такой конференции приглашаются работники комитета по охране природы, данные ученики-докладчики являются своего рода “специалистами-экологами”. После выступления задаются вопросы.
По ходу конференции ученики заносят в тетрадь краткую характеристику явления и пути предотвращения катастрофы.
Свою работу завершают составлением небольшой схемы о межпредметном взаимодействии.
Задание на дом – подписать влияние над стрелками, т.е. домашнее задание учащихся будет представлено следующей схемой:
![]()
![]() Человек
Человек
Биология
![]()
![]() Ботаника
Химия
География
Ботаника
Химия
География


![]()
Физика
Приложение 6
“Приготовление растворов солей с определенной
массовой долей w растворенного вещества”
Предлагаем им задачу следующего содержания: “Юные цветоводы попросили юных химиков приготовить каждому из них по 80 г раствора аммиачной селитры с w ее в растворе 0,15. Назовите и рассчитайте действия юных химиков. Раствор с какой w аммиачной селитры получат цветы, если до и после подкормки почву промывают по 100 мл воды.”
Прежде чем разрешить учащимся приступить к выполнению данной задачи, повторяем с ними основные формулы:
1. mр-ра = mраст.в-ва + mраст-ля
2. w = (mраст.в-ва/mр-ра)·100%
mраст.в-ва = mр-ра·w; mр-ра = mраст.в-ва/w
Записываем краткое условие задачи.
Дано:
m1(р-ра) = 80 г
w1 = 0,15
m2(H2O) = 200 г
Найти: w2
Решение.
1. Рассчитаем массу аммиачной селитры
mам.с. = 80 г·0,15 = 12 г
2. Рассчитаем массу воды для растворения 12 г минеральных удобрений
mводы = 80 - 12 = 68 г
3. Берут цилиндр, отмеряют 68 мл воды и всыпают 12 г аммиачной селитры.
4. Рассчитывают, каков объем получаемый растениями до, во время и после подкормки и поливки. Отсюда следует, что
m2(р-ра) = 200 + 80 = 280 г
5. Рассчитывают w2
w2 = 12/280 = 0,04; w = 4%
Ответ: цветы получили раствор аммиачной селитры с w = 0,04.
Можно предложить учащимся составить обратную задачу и решить ее самостоятельно.
Приложение 7
Фрагмент урока по теме “Ионная связь”
Цели: образовательные: дать понятие ионной связи, объяснить механизм образования данной связи, провести сравнение с ковалентной связью;
развивающие: закрепить понятие о ковалентной связи, полярной и неполярной; об электроотрицательности, развитие общеучебных умений анализировать, выделять главное, применять знания из курса географии;
воспитывающие: формировать у учащихся убежденность в познании мира веществ.
Фрагмент объяснения механизма образования ионной связи:
| СУМ | УПДУ |
|
+1; -1 - степень окисления Na0 + Cl0 ® Na+ Cl- В данном случае общей электронной пары не образуется потому, что электрон от атома Na с внешнего энергетического уровня переходит на внешний энергетический уровень атома Cl, т.к. Cl более электроотрицателен. Спаривание электронов происходит в атоме элемента Cl.
Соединения, которые при этом образуются, называются ионными соединениями. Ионная связь образуется между металлами и галогенами. NaCl - хлорид натрия |
Что такое степень окисления? Ответ: Что такое ион? (из курса физики) Запись примера в тетрадь. Почему? Что такое электроотрицательность? Ответ: Как называется ионное соединение NaCl в быту и где в Арх. обл. находится самое старое месторождение этого полезного ископаемого? Ответ: поваренная соль, г. Сольвычегодск. |
На доске рисуем схемы взаимодействия щелочных металлов с галогенами. В результате химического взаимодействия атомы галогенов притягивают валентные электроны атомов металлов и образуются ионы. Далее задаем учащимся такие вопросы: Как будут вести себя одноименно или разноименно заряженные ионы, если они окажутся рядом? Какие силы удерживают ионы в ионных соединениях?
Заключение урока - обобщение знаний, формулировка полного определения ионной связи.
Приложение 8
Тему “Углерод, подгруппа углерода.” можно завершить зачетным уроком по составлению обобщающей схемы, которая пригодится для сдачи экзамена по химии и приведет в систему знания учащихся, дополняя в старших классах.
Углерод C, IV группа, главная подгруппа
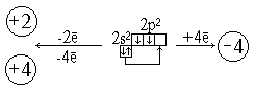
Значит углерод может обладать и окислительными и восстановительными свойствами.
В природе: органические вещества, CO2; CaCO3 – мрамор, мел; MgCO3 – магнезит; FeCO3 – железный шпат.
Физические свойства: 4 аллотропные модификации.
| алмаз | графит | карбин | линейный ацетиленовый углерод |
|
sp3-гибридизация, тетраэдрические s-связи, прочные ковалентные, поэтому очень тверд |
sp2-гибридизация, слоистая структура, большое расстояние и непрочные связи между слоями, поэтому мягкий |
sp-гибридизация, линейный полимер, твердое вещество
|
разновидность сажи |
Новая форма линейного углерода
В дополнение к известным формам структуры углерода – палкам, тубам и сферам – группой химиков во главе с Ричардом Дж. Лэгоу из Техасского университета (США) открыта новая аллотропная форма этого элемента – линейный ацетиленовый углерод. Он является разновидностью сажи и представляет собой тончайшие нити в виде паутины янтарного цвета. По этой причине его назвали “волосы ангела”.
Каждая нить новой аллотропной формы углерода содержит от 300 до 500 углеродных атомов, связанных друг с другом чередующимися одинарными и тройными связями. Исследователям удалось осуществить синтез новой формы с помощью лазера путем взрывообразного испарения графитового стержня в заполненном аргоном стеклянном реакторе. Образовавшиеся на стенках реактора нити могут быть легко собраны.
Полученные углеродные нити весьма реакционно способны и проводят электрический ток. Химики полагают, что многие из этих нитей закручены в спирали, которые могут превращаться в фуллерены или сажу. Свойства новой аллотропной формы углерода позволяют надеяться на ее применение в микроэлектронике, синтезе алмазов, а также в качестве топлива для реактивных двигателей и топливных элементов.
Сокр. перев. с англ.
Г.Т. Хачатуровой
(Science News, 1995,
v.147, № 5, p.77)
Получение углерода
![]()
![]() Сухая
перегонка
Сухая
перегонка
древесины каменного угля
древесный уголь кокс
активированный уголь
Самый чистый углерод – сажа
CH4 ® C + 2H2
Химические свойства
- малоактивен, на холоде – только с F2 ® CF4
Восстановитель ¬ Слабо выражены ® Окислительные
1) O2 + C ® CO2 ниже 500°C ь
э загорается
CO2 + C ® CO выше 900°Cю
2) H2O + C ® CO + H2 выше 1200°C
2H2O + C ® CO2 + CO2 + H2 выше 1000°С
3) CuO + C ® Cu + CO при t
Cu+2 +2e® Cu0 – окислитель, восстанавливается
C0 -2e® C+2 – восстановитель, окисляется
4) HNO3 + 3C ® 3 CO2 + 4 NO + 2 H2O
с H2SO4 разбавленная
Cu+2 +2e® Cu0 – окислитель, восстанавливается
C0 -2e® C+2 – восстановитель, окисляется
![]() C
C
![]() 1)
Ca + 2C ®
Ca ъъъ
карбид кальция
1)
Ca + 2C ®
Ca ъъъ
карбид кальция
C
C + Si ® CSi карборунд
другой способ:
CaO + C ® CaC2 + CO
2) 2H2 + C ® C-4H+4
Рассмотрим с точки зрения ox-red:
4H0 -4e® 4H+ – восстановитель, окисляется
C0 +4e® C-4 – окислитель, восстанавливается
Углерод может быть и окислителем и восстановителем.
| 4+ | 2+ | n- |
|
Оксид углерода (IV) CO2
Без цвета и запаха, растворим в воде; -76°C – сухой лед; Получение: в промышленности обжиг известняка CaCO3 ® CaO + CO2 в лаборатории – вытеснение сильной кислотой CaCO3 + 2HCl ® CaCl2+ + CO2 + H2O Окислительные свойства выражены слабо: только при высоких температурах, с металлами, сродство к кислороду, которых больше, чем у C (Mg, K) 2Mg + CO2 ® 2MgO + C Кислотный оксид при растворении в воде, образуется небольшое количество угольной кислоты
1. 2NaOH + CO2 ® ® Na2CO3 + H2O; Na2CO3 + H2O + CO2 ® ® 2NaHCO3 Этим способом могут быть получены соли угольной кислоты. Другой способ: 2. Обменная реакция BaCl2 + Na2CO3 ® ® BaCO3Ї + 2NaCl Соли: 1) карбонаты, растворимы в воде – только щелочных и NH+4 сильный гидролиз. При нагревании Ca(HCO3)2 ® CaCO3 + + CO2 + H2O CaCO3 ® CO2 + CaO Карбонаты щелочных металлов плавятся без разложения. Качественная реакция “вскипание” – сильная кислота CaCO3 + 2HCl ® CaCl2+ + CO2 + H2O CO2 вызывает помутнение известковой и баритовой воды Ca(OH)2 + + CO2 ® CaCO3 + H2O Растворение, ведущее к разрушению старых известковых гор. CaCO3 + H2O + CO2 ® ® Ca(HCO3)2 |
Оксид углерода (II) CO (угарный газ)
Бесцветный газ, без запаха, ядовит, т.к. соединяется с гемоглобином крови. Плохо растворим в воде. Получение: горение при недостатке O2 2C + O2 ® 2CO 2CH4 + 3O2 ® 2CO + + 4H2O В лаборатории: действие концентрирован. H2SO4 HCOOH ® CO + H2O Щавелевая кислота H2C2O4 ® CO + CO2+ + H2O Восстановитель Fe2O3 + + 3CO ® 2Fe + 3CO2 O2 + 2CO ® 2CO2 Несолеобразующий, но при t = 200°C, 20 атм NaOH + CO ® O ® HC O – Na |
Органические соединения CH4 карбиды – получаются при непосредственном взаимодействии с металлами. 2 группы. I. Карбиды металлического характера. Переходные Me + C. Электронная проводимость, металлический блеск. II. Ионные карбиды более электроположительные, бесцветные, прозрачные, не проводят электрический ток. 1) Al4C3 + 12H2O ® ® 4Al(OH)3 + 3CH4 c Be2C – та же реакция 2) CaC2 + 2H2O ® ® Ca(OH)2 + C2H2 Na2C2; K2C2; SrC2; BaC2; Cu2C2 При гидролизе – ацетилен и ненасыщенные углеводороды из Mg2C2; Fe3C, лантанидов. |
Приложение 9
Для контроля знаний по теме “Подгруппа углерода” можно привести несколько примеров в виде тестов.
Карточка 1.
1. Электронная конфигурация атома углерода в свободном состоянии:
а) 1s2 2s2 2p2;
б) 1s2 2s2 2p6;
в) 1s2 2s2 2p6 3s2 3p2;
г) 1s2 2s2 2p6 3s2 3p6 .
2. Валентность углерода в органических соединениях:
а) 1;
б) 4;
в) 2;
г) 3.
3. Степень окисления углерода в соединениях состава CH4:
а) 0;
б) +2;
в) +4;
г) -4.
4. В данной химической реакции углерод является:
2H2 + C ® СH4
а) восстановителем
б) окислителем,
5. По химическим свойствам углерод относится к:
а) неметаллам;
б) металлам.
Ключ для проверки:
1. а. 2. б. 3. г. 4. б. 5. а.
Карточка 2.
1. Какие реакции, схемы которые приведены ниже, используются для получения оксида углерода (IV) в лаборатории:
а. СaCO3 + HCl ®
б. C + O2 ®
в. СaCO3 ®
г. CO + O2 ®
2. Степень окисления углерода в его высшем оксиде;
а) 0;
б) +2;
в) +4;
г) -4.
3. Какие вещества, формулы которых приведены, можно использовать для осушения углекислого газа:
а) концентрированная серная кислота;
б) оксид фосфора (V);
в) гидроксид натрия;
г) оксид кальция.
Напишите возможные уравнения реакции.
4. Какие соли дает угольная кислота;
а) силикаты;
б) хлориды;
в) сульфаты;
г) карбонаты.
Ключ для проверки ответов учащихся при перфокартном контроле:
| Фамилия, имя..................... Борисова Мария | ||||
| вопросы | ответы | |||
| а | б | в | г | |
| 1 | + | |||
| 2 | + | |||
| 3 | + | + | ||
| 4 | + | |||
62
Глава 2. Химия элемента углерода и его соединений
2.1 История открытия углекислого газа
Углекислый газ был первым между всеми другими газами противопоставлен воздуху под названием “дикого газа” алхимиком XVI в. Ван-Гельмонтом. Открытием углекислого газа было положено начало новой отрасли химии – пневматохимии (химии газов).
“Уголь, – утверждал Ван-Гельмонт, – и вообще все горючие вещества освобождают необходимым образом при своем горении “дикий газ”. 62 ливра дубового угля дают один ливр золы. Остальные 61 ливр пошли на образование “дикого газа”. Этот “воздух”, неизвестный до сих пор, который нельзя ни собрать в сосуды, ни превратить в видимое тело, я называю новым именем – газ.
Есть тела, которые таят в себе этот газ; он в них, таким образом, как бы фиксирован или отвержен. Его выводят из этого состояния посредством фермента, как это наблюдается при брожении вина, теста, пива. Винное сусло, яблочный сок, ягоды, мед под влиянием фермента приходят как бы в кипение, производимое выделением газа. Этот газ, сдавленный с большой силой в бочках, делает вина пенящимися и игристыми.”
Тот же самый газ, который выделяется при горении угля и брожении вина, оказывается далее, может получаться и из других, крайне отличных друг от друга источников, а именно:
1. При действии кислоты на скорлупу (“в момент, когда уксус растворяет раковую скорлупу”).
2. В пещерах, копях и погребах (“ничто не волнует так сильно, как зрелище газа в собачьей близ Неаполя. Очень часто он убивает тех, кто работает в копях; можно мгновенно оказаться удушенным им в погребах”).
3. В некоторых минеральных водах (“воды сна выделяют дикий воздух”).
Этим открытием Ван-Гельмонта был заложен фундамент пневматохимии. И этот же Ван-Гельмонт, выращивая в течение 5 лет взвешенный отросток вербы во взвешенном количестве земли и не обнаружив после этого убыль веса земли, пришел к убеждению, что растения образуются из воды, которой они поливаются, ни минуты не подумав, что источником прибыли веса растения может являться воздух или открытый им газ.
Единственное испытание, которому подвергал Ван-Гельмонт разные газы для отличения их друг от друга, была горящая свеча – средство, еще не достаточное для отличения углекислого газа, например, от азота, который тоже не поддерживает горения и действует на живые существа удушающим образом, как и “дикий воздух” Ван-Гельмонта.
То свойство углекислого газа, по которому углекислый газ действительно можно отличить почти от всякого другого газа, его способность “притягиваться” известковой водой и мутить ее, было обнаружено Блэком; за это отличие от обыкновенного воздуха Блэк и дал дикому газу (“может быть, весьма неудачно”) новое название: фиксируемый воздух.
Несколько лет спустя Кавендиш, верный своему правилу все определять “мерой, числом и весом”, обнаружил еще два характерных физических свойства углекислого газа: его высокий удельный вес и значительную растворимость в воде.
Вскоре затем Лавуазье предпринял опыт, которому суждено было направить химические исследования в новое русло. Задавшись целью выделить из окалины свинца ту составную часть воздуха, которая, по его предположению, присоединилась к свинцу и вызвала увеличение веса, Лавуазье прокалил оксид свинца с углем и получил газ, который хорошо растворялся в воде, осаждал известковую воду, гасил пламя и удушал животных, одним словом, имел “все свойства в точности такие же, какие присущи виду воздуха, известному под названием фиксируемого воздуха”.
Этот фиксируемый воздух, т.е. углекислый газ, Лавуазье ошибочно принял вначале за ту составную часть обыкновенного воздуха, которая присоединяется металлами при прокаливании. Что фиксируемый воздух содержится в атмосфере, Блэком уже было доказано: оставленная в открытом сосуде на воздухе известковая вода с течением времени мутится.
Лавуазье понял свою ошибку лишь после встречи с Пристли, который сам того не подозревая, посредством своего опыта с “ртутной окалиной” уже решил задачу, над которой бился Лавуазье. Лавуазье тотчас же повторил свой опыт восстановления углем окалины металла, лишь заменив окись свинца окисью ртути и на этот раз дал правильное истолкование: “Поскольку уголь полностью исчезает при восстановлении ртути из ее окалины и поскольку при этой операции получаются только ртуть и фиксируемый воздух, поскольку фиксируемый воздух есть соединение жизненного воздуха (кислорода) с углем, т.е. окисел (оксид) углерода”.
2.2 Строение молекулы углекислого газа
2.2.1 С позиции ВС
Молекула оксида углерода (IV) имеет следующее строение: атом углерода переходит в возбужденное состояние, имея 4 неспаренных электрона.
C +6 )) 1s2 2s2 2p2 Ю C* +6 )) 1s2 2s1 2p3
24
O +8 )) 1s2 2s2 2p4
26
Mr(CO2) = 12,011 + 15,999 · 2 = 44,009 » 44
Молекула оксида углерода (IV) состоит из двух атомов кислорода и одного атома углерода.
Электронная формула Структурная формула
·· · · ··
O · C ·· O O = C = O
·· ґ ґ ··
Все 4 ковалентные связи полярны. Молекула имеет линейную форму. Это объясняется следующим образом: в многоатомных молекулах связь между атомами может быть полярной, а сами молекулы в зависимости от пространственного строения могут быть как полярными, так и неполярными. Электрический момент диполя в таких молекулах определяется числом полярных связей и их направленностью. Он равен векторной сумме моментов диполя отдельных связей. Например, электрический момент диполя связей C = O равен 9·10-30 Кл·м, а молекулы CO2 – нулю. Т.к. в линейной молекуле CO2 векторы связей радиально направлены от центра, а потому результирующий момент m равен нулю.
Cd+
·
·
·
![]() Od-
Od-
Od-
Od-
·
·
·
Рис.1. Геометрическое сложение электрических моментов диполей связей в молекуле углекислого газа
Раз каждая из связей углерод-кислород является полярной, поэтому на каждом из атомов кислорода должен быть некоторый отрицательный заряд, а на углероде сосредоточен положительный заряд. Поскольку атомы кислорода расположены на одной прямой по обе стороны от атома углерода на равных расстояниях, центры распределения положительных и отрицательных зарядов совпадают. Вследствие этого заряд на углероде полностью нейтрализуется.
Значит, хотя каждая из связей углерод-кислород полярна, молекула углекислого газа в целом является неполярной и причиной тому является ее линейное строение.
2.2.2 с позиции МЛКАО
Мы знаем, что форма молекулы диоксида углерода линейная. У атома кислорода имеются орбитали p-типа.
На рис.2 показаны валентные орбитали центрального атома (углерода) и групповые орбитали лигандов (атомов кислорода).
а) б)
Рис.2. Орбитали центрального атома (а) групповые орбитали (б) для трехцентровой линейной молекулы CO2.
Вследствие большого энергетического различия 2s и 2p орбиталей кислорода участием 2s орбиталей можно пренебречь. Сочетание орбиталей 2s-y1, 2pz-y2 приводит к образованию молекулярных орбиталей s-типа: ssсв, ssразр и szсв, szразр.

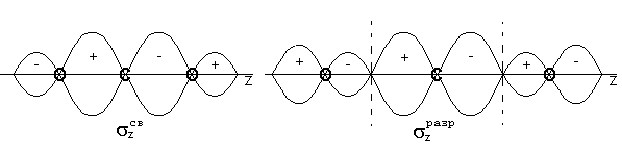
Рис.3. Связывающие и разрыхляющие S-орбитали молекулы углекислого газа
Комбинация орбиталей 2px-y3 и 2py-y5 приводит к образованию трехцентровых орбиталей p-типа: pxсв, pxразр и pyсв, pyразр (рис.4). Для групповых орбиталей y4 и y6 подходящих по симметрии орбиталей центрального атома нет, поэтому в молекуле CO2 они играют роль несвязывающих и обозначаются px и py. Несвязывающие орбитали локализованы у атомов кислорода (рис.4)
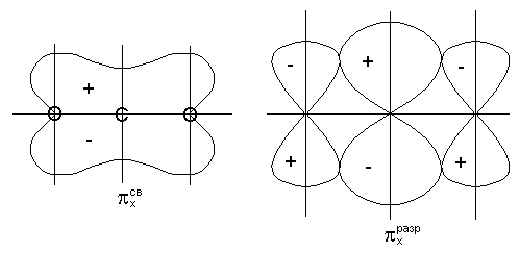
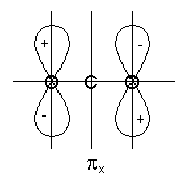
Рис.4. p-связывающие, разрыхляющие и несвязывающие орбитали молекулы CO2.
Приближенная энергетическая диаграмма молекулы CO2 показана на рис.5. Распределение валентных электронов (четыре атома углерода и восемь – двух атомов кислорода) по орбиталям молекулы CO2 соответствует электронной конфигурации
(szсв)2 (szсв)2 (pxсв)2 (pyсв)2 (px)2 (py)2,
а с учетом 2s-электронов двух атомов кислорода
(2SA)2 (2SB)2 (ssсв)2 (szсв)2 (px,y)4 (px,y)4.
Четыре пары электронов приходятся на четыре трехцентровые связующие орбитали, т.е. на каждый из атомов кислорода приходится по две пары связывающих электронов. Таким образом, можно считать, что порядок связи между атомом кислорода и углерода в молекуле CO2 равен 2. Это можно отразить структурной формулой O = C = O.
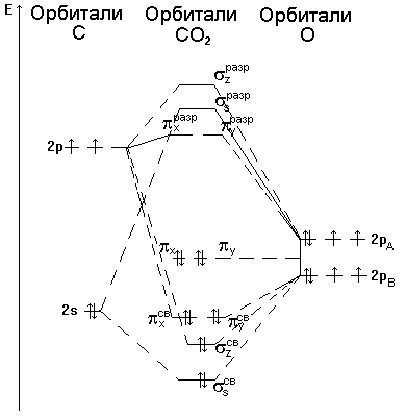
2.3 Физические свойства углекислого газа
Углекислый газ (оксид углерода (IV) или угольный ангидрид) – бесцветный газ, имеющий слабокислый запах и вкус, в 1,5 раза тяжелее кислорода, поэтому можно его переливать из стакана в стакан. r = 1,98 г/л. В одном объеме воды при 20°С растворяется 0,88 объема CO2. При охлаждении в условиях нормального давления газ затвердевает при -78,515°C, минуя жидкое состояние. Твердый оксид углерода (IV) – снегообразная масса, называемая сухим льдом. Жидкий CO2 образуется только под давлением при 20°C; 58,46·105 Па. В жидком состоянии хранится и транспортируется в стальных баллонах. При открывании вентиля баллона происходит сильное охлаждение и часть газа переходит в сухой лед. Легко возгоняется, затвердевает. Давление паров: 133,32Па (-135,1°C); 1,3332 кПа (-119,6°C); 13,332 кПа (-100,2°C); 53,328 кПа (-86,0°C). tпл = -56,6°C (0,52 МПа). Коэффициент растворимости в сыворотке крови человека 0,58. Содержание в воздухе 4% по объему CO2 вызывает болезненный явления, при концентрации CO2 выше 10% появляется удушье.
Оксид углерода (IV) – конечный продукт дыхания растений и животных, а также процессов горения, дыхания, гниения, брожения. Служит источником питания зеленых растений – фотосинтез.
Углекислый газ бесцветен, т.е. не поглощает никаких видимых лучей. Но в инфракрасной части спектра углекислого газа наблюдаются широкие линии поглощения; для инфракрасных, иначе говоря, тепловых, лучей углекислый газ мало прозрачен. Поэтому, если бы атмосфера Земли состояла из углекислого газа, она выполняла бы роль стекла в парниках, солнечное излучение достигало бы сквозь нее поверхности Земли беспрепятственно без заметного ослабления и сильно нагревало бы ее, но обратное тепловое излучение Земли в мировое пространство очень сильно задерживалось бы мало прозрачным для тепловых лучей углекислым газом. От этого климат Земли резко утеплился (“Парниковый эффект”, глава “География”).
2.4 Химические свойства углекислого газа
Оксид углерода (IV) химически довольно активен. Рассмотрим некоторые реакции.
1. Оксид углерода (IV) – кислотный оксид, ему соответствует двухосновная угольная кислота. Растворение оксида углерода (IV) – обратимая реакция.
H2O + CO2
![]() H2CO3
H2CO3
равновесие при комнатной температуре на 99% сдвинуто влево
Углекислый газ не просто растворяется в воде, а частично соединяется с нею, образуя угольную кислоту.
2H2O + CO2
![]() H3O+ +
HCO3-
H3O+ +
HCO3-
Однако угольная кислота – соединение крайне непрочное. Она может присутствовать лишь в водном растворе, при всякой же попытке выделить угольную кислоту из раствора она опять разлагается на CO2 и H2O.
H2CO3
![]() H+ + HCO3
KaI = 4,45·10-7
H+ + HCO3
KaI = 4,45·10-7
HCO3-
![]() H+ + CO3
KaII = 4,69·10-11
H+ + CO3
KaII = 4,69·10-11
2. С сильными основаниями оксида углерода (IV) реагирует с образованием солей угольной кислоты – карбонатов и гидрокарбонатов.
Ca(OH)2 + CO2 ® CaCO3Ї + H2O
CaCO3 + H2O + CO2 ® Ca(HC03)2
3. Углекислый газ – вещество очень прочное, тем не менее при температуре красного каления с кальцием дает карбид и оксид кальция.
2CO2 + 5Ca ® CaC2 + 4CaO
4. Наиболее активные металлы горят в оксиде углерода (IV).
600°C
2Mg + CO2 ® 2MgO + C
5. При высоких температурах восстанавливается в CO с железом, цинком, углем.
3CO2 + 4Fe ® 2Fe2O3 + 3C
CO2 + C ® 2CO
6. С водородом в присутствии никеля при 350-400°C или оксида меди (II) при 200°C восстанавливается в метан.
350-400°C
CO2 + 4H2 ® CH4 + 2H2O
Ni
7. С аммиаком при 600°C дает карбамид.
CO2 + NH3 ® CO(NH2)2
8. С сероуглеродом в присутствии меди дает
CO2 + CS2 ® 2S + 2CO
9. Реагирует со многими органическими соединениями, карбоксилируя их. Пиррол, подобно фенолу карбоксилируется оксидом углерода (IV), образуя 2-пирролкарбоновую кислоту, а в более жестких условиях температуры 3-пирролкарбоновую кислоту.
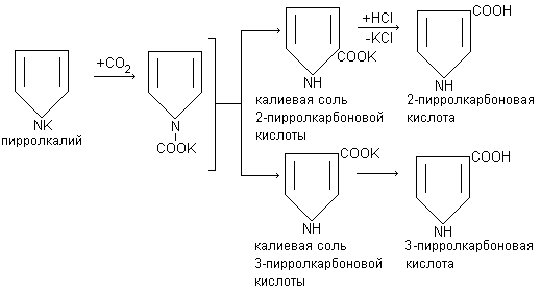
2.5 Получение углекислого газа
В химических лабораториях либо пользуются готовыми баллонами с жидким угольным ангидридом, либо получают двуокись углерода в аппаратах Киппа действием соляной кислоты на куски мрамора. Пользоваться серной кислотой вместо соляной при этом нельзя, потому что тогда вместо растворимого в воде хлорида кальция получился бы гипс – соль, малорастворимая в воде. Отлагаясь на куски мрамора, гипс крайне затрудняет доступ к ним кислоты и тем самым очень замедляет течение реакции. От примеси паров хлористого водорода двуокись углерода освобождается в промывной склянке с водой, а от паров воды – в следующей склянке с серной кислотой.
В промышленности двуокись углерода получается главным образом как побочный продукт обжига известняка, спиртового брожения.
2.6 Применение углекислого газа
Г.Кавендиш первый обратил внимание на то, что водный раствор двуокиси углерода имеет хотя и слабый, но приятный кислый вкус. Он продемонстрировал в Королевском обществе стакан “чрезвычайно приятно искрящийся (шипучей) воды, едва ли отличной от сельтерской воды” и получил за это открытие золотую медаль общества. Это было первое практическое применение диоксида углерода, им заинтересовались американские предприниматели (когда Д.Пристли находился уже в эмиграции), после того как один доктор стал прописывать карбонизированную воду с добавкой фруктовых соков своим пациентам. Отсюда и стала развиваться промышленность газированных напитков, которая до сих пор является одним из важнейших потребителей углекислого газа.
Диоксид углерода применяют для газирования фруктовых и минеральных вод, для производства сахара, пива, в медицине для углекислых ванн. Его наполняют спасательные пояса и плоты из маленьких стальных баллонов с жидкой массой диоксида углерода. Жидкий угольный ангидрид применяют:
1) в портативных огнетушителях;
2) в огнетушительных системах самолетов и кораблей, пожарных углекислотных машинах.
Такое широкое применение в огнетушении связано с тем, что в некоторых случаях вода не годится для тушения, например, при тушении загоревшихся огнеопасных жидкостей или при наличии в помещении невыключенной электропроводки, уникального оборудования, которое от воды может пострадать.
Применение прессованного твердого угольного ангидрида, который мы называем сухим льдом, тоже достаточно широкое. Так его используют для поддержания низкой температуры в вагонах-холодильниках для транспорта скоропортящихся продуктов, а также при производстве мороженого. Почему, возникает вопрос, нельзя использовать обыкновенный лед. А оказывается сухой лед имеет ряд преимуществ:
1. позволяет поддерживать в холодильнике, роль которого у продавцов мороженого играет простой картонный короб, гораздо более низкую температуру до -78,2°C;
2. поглощает при испарении втрое больше теплоты на единицу массы, чем лед при плавлении;
3. не загрязняет холодильника, как обыкновенный лед, жидким продуктом плавления;
4. создает в холодильнике атмосферу из диоксида углерода, дополнительно предохраняющую пищевые продукты от порчи.
Сухой лед применяют также для охлаждения и отвердевания заклепок из алюминиевых сплавов и при надевании бандажей – металлических колец или поясов на части машин.
Углекислый газ применяется также как теплоноситель в графитовых реакторах.
Очень интересное применение оксида углерода IV для изменения погоды: при рассеивании порошка сухого льда с самолета, пролетающего над переохлажденным облаком, создается искусственный снегопад над аэродромами (при расходе всего примерно 100 г льда на 1 км3 облака). При этом начинают падать густые мокрые хлопья снега, а вскоре сквозь сплошную облачность начинает просвечивать небо. Просветы быстро расширяются и сливаются в широкое синее небо. В результате сильного охлаждения замерзают лишь немногие водяные капельки. Остальные остаются в переохлажденном состоянии. Но так как при одной и той же температуре переохлажденная вода имеет большую упругость пара, чем лед, тотчас начинается нарастание ледяных кристаллов за счет капелек жидкой воды, что и приводит к снегопаду.
Во многих случаях угольный ангидрид используют не в готовом виде, а получают в процессе использования. В таких случаях исходные вещества применяют либо раздельно – как серная кислота и дикарбонат натрия в обычных огнетушителях, либо в виде смеси двух сухих порошков (как в некоторых хлебопекарных порошках), например, смесь бикарбоната натрия с кислым виннокислым калием, виннокислым аммонием или хлоридом аммония. Пока такая смесь остается сухой, реакция не происходит. При добавлении воды соли растворяются, диссоциируют, и возникает ионная реакция с выделением диоксида углерода.
Подобные реакции происходят в результате смешивания хлебопекарных порошков с тестом для разрыхления теста химическим путем, без применения биологических средств – дрожжей и заквасок. В результате тесто “всходит”, наполняясь пузырьками диоксида углерода, и выпеченный из него продукт получается мягким и легче переваривается.
Углекислый газ выступает как инертная атмосфера.
Вот такое широкое применение имеет оксид углерода (IV). Здесь показаны лучшие его качества, но не весь углекислый газ бывает полезен человеку и природе.
2.7 Круговорот углекислого газа в природе
В истории зеленого углерода можно различить несколько этапов. До появления водной оболочки Земли углерод главным образом входил в состав земной атмосферы в виде углекислого газа. Об этом свидетельствует анализ газовых включений в силикатных минералах: кислород в них отсутствует, а содержание углекислого газа достигает 96%. С охлаждением земной коры и появлением жидкой воды, насыщенной углекислым газом, начинается процесс выветривания магматических горных пород, сводящийся в основном к вытеснению кремниевой кислоты из силикатов угольной кислотой, как кислотой более сильной. Нерастворимые продукты разрушения горных пород в виде рыхлых масс остаются на листе, а растворимые соли, в том числе дикарбонаты, увлекаются в мировой океан. Таким образом создается необходимое сочетание условий для возникновения растительной живой материи: углекислый газ, жидкая вода и растворенные в ней соли.
В мировом океане зародилась жизнь; это начало нового этапа в геохимической жизни углерода. В результате основного процесса жизнедеятельности растений – фотосинтеза – углерод из атмосферы переходит в состав живой массы биосферы, и состав атмосферы постепенно изменяется, углекислый газ в ней сменяется кислородом. Таким образом возникают необходимые предпосылки к возникновению животной жизни: свободный кислород и накопленные растениями органические вещества.
Рисунок сводит отдельные, рассмотренные выше превращения углекислого газа в природе в единую цельную картину.
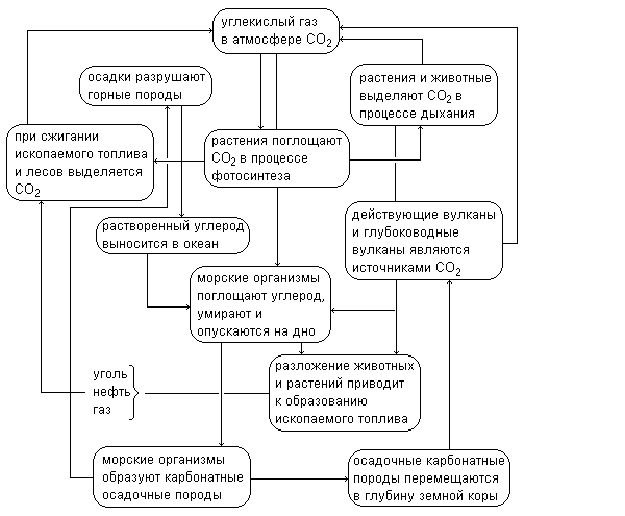
Углекислый газ используется в процессе фотосинтеза для образования органических веществ. Именно благодаря этому процессу замыкается круговорот углерода в биосфере. Как и кислород, углерод входит в состав почв, растений, животных, участвует в многообразных механизмах круговорота веществ в природе. Содержание углекислого газа в воздухе, который мы вдыхаем, примерно одинаково в различных районах планеты. Исключение составляют крупные города, в которых содержание этого газа в воздухе бывает выше нормы.
Некоторые колебания содержания углекислого газа в воздухе местности зависят от времени суток, сезона года, биомассы растительности. В то же время исследования показывают, что с начала века среднее содержание диоксида углерода в атмосфере, хотя и медленно, но постоянно увеличивается. Ученые связывают этот процесс главным образом с деятельностью человека.
Как и каждый химический элемент, углерод в земной коре находится в постоянном движении, преобразовании из одной химической формы соединений в другую; эти изменения замыкаются в целую систему взаимно переплетающихся циклов. Исходя из одной определенной формы существования углерода, например из CO2, и последовательно прослеживая его преобразования мы вновь возвратимся в исходную точку – в CO2.
В минеральной природе главными генераторами углекислого газа являются вулканы, не только действующие, но и давно потухшие; вулканические местности изобилуют выделяющимися из под земли струями углекислого газа и ключами, постоянно выбрасывающими CO2 из земных недр в виде раствора, насыщенного углекислым газом (нередко под большим давлением).
В минеральной природе диоксид углерода расходуется процессами выветривания. Это крайне медленные химические реакции; мы непосредственно не можем проследить их течение. Но, встречая на поверхности земли полуразрушенные выветриванием глубинные породы, например гранит в окружении продуктов его разрушения – песка и глины, мы легко можем мысленно воссоздать процесс разрушения, всякий раз необходимым участником агрессии, постигшей изверженную породу, окажется углекислый газ. Таким образом, с точки зрения геохимии углерода, процессы выветривания – это процессы связывания углекислого газа. Именно углекислый газ является главным деятелем процессов выветривания, а так как они идут повсеместно, и охватывают неизмеримо большие массы минеральной материи, диоксид углерода извлекается ими из атмосферы в настолько больших количествах, что по расчетам геологов, углекислого газа, содержащегося в данный момент в атмосфере, хватило бы на процессы выветривания не больше чем на 18000 лет.
Масштабы процессов, пополняющих атмосферу углекислым газом и расходующих его, представляются в современную эпоху существования земного шара таблицей:
Масштабы круговорота угольного ангидрида (в млрд. т в год).
| Поступление в атмосферу | Уход из атмосферы |
| Из океанов 200 | В океаны 200 |
| Дыхание и гниение 60 | Фотосинтез 60 |
| Горячие источники и вулканы 0,1 | Выветривание 0,1 |
| Сжигание топлива 6 | |
| Освоение целинных земель 2 |
Из таблицы видно, что в природе образование и расходование углекислого газа сбалансированное. Но деятельность человека нарушает баланс. Сопоставление анализов воздуха на протяжении последних 100 лет обнаруживает постепенное накопление диоксида углерода в атмосфере. С этим предположительно связывают некоторое смягчение климата на земном шаре.
Круговорот углерода представляется нам движением по замкнутому кругу, однако в рамках сравнительно ограниченного геологического срока; если же рассматривать историю углерода в целом, начиная с возникновения его первых простейших соединений и кончая зарождением, постепенным усложнением и усовершенствованием органической материи, легко убедиться, что в действительности круговорот углерода не простое повторение пройденного, а движение поступательное, по восходящей линии, развитие от простого к сложному, от низшего к высшему. Это относится и к круговороту всех других элементов, образующих земной шар.
2.8 Гигиенические нормативы предельно допустимой концентрации (ПДК)
Оказывается, у людей появляется привыкание к углекислому газу. Но существует в странах мира ПДК углекислого газа в атмосфере. К сожалению у нас в России ПДК в воздухе рабочей зоны не установлена, в США – 9000 мг/м3. В угольных и озокеритовых шахтах разрешается содержание углекислого газа до 0,5%. По данным Елисеевой, в жилых и общественных зданиях среднесуточная концентрация не должна превышать 0,05% углекислого газа, а кратковременная (разовая) – 0,01%.
4
Содержание
Введение......................................................................................................................4
Глава 1. Межпредметные связи в курсе школьного предмета химии на примере углерода и его соединений.......................................................................5
1.1 Использование межпредметных связей для формирования у учащихся основ диалектико-материалистического мировоззрения....................................7
1.2 Пути и методы реализации межпредметных связей......................................11
1.3 Межпредметные связи в процессе изучения химии в 9 классе.....................13
1.4 О связи обучения химии и географии..............................................................16
1.5 Межпредметные связи неорганической, органической химий и физики.........................................................................................................................18
1.6 Межпредметные связи при проблемном обучении химии............................27
1.7 Межпредметные связи при решении расчетных задач..................................33
Глава 2. Химия элемента углерода и его соединений.........................................37
2.1 История открытия углекислого газа...............................................................37
2.2 Строение молекулы углекислого газа.............................................................40
2.2.1 С позиции валентных связей..........................................................................40
2.2.2 С позиции МЛКАО.........................................................................................42
2.3 Физические свойства углекислого газа...........................................................46
2.4 Химические свойства углекислого газа..........................................................47
2.5 Получение углекислого газа.............................................................................49
2.6 Применение углекислого газа...........................................................................50
2.7 Круговорот углекислого газа в природе.........................................................53
2.8 Гигиенические нормативы предельно допустимой концентрации (ПДК)..........................................................................................................................58
Глава 3. Роль соединений углерода в природе.....................................................59
3.1 Роль углекислого газа в создании парникового эффекта.Углекислый газ и парниковый эффект..................................................................................................59
3.2 Основные загрязнители атмосферы.................................................................69
3.2.1 Природные источники....................................................................................69
3.2.2 Авиация.............................................................................................................70
3.2.3 Машиностроительное предприятие..............................................................73
3.2.4 ТЭС....................................................................................................................74
3.2.5 Транспорт.........................................................................................................74
3.3 Борьба с выбросами углекислого газа и их учет...........................................75
3.4 Океаническая вода как пожиратель углекислого газа.................................78
3.5 Неравномерное потребление углекислоты наземными системами.............81
3.6 Выводы.................................................................................................................85
Заключение................................................................................................................89
Библиография
Приложения
91
Заключение
В ходе работы удалось проследить взаимосвязь между школьными предметами: химией, географией, физикой, биологией, математикой. Ознакомилась с методами и путями реализации МПС и опробовала на педагогической практике. Чаще всего удавалось использовать фрагментарный метод, реже узловой. На уроках повторения и обобщения темы – наиболее эффективным является синтезированный метод, с помощью его осуществляются связи межпредметные (МП) и внутрипредметные (ВП). При использовании методов вводила различные средства реализации (вопросы МП характера, МП задачи, домашние задания, наглядные пособия, химический эксперимент). Все это давало неплохой результат, у учащихся возрастает интерес к предметам. Необходимо использовать МПС на всех уроках, научить самостоятельно находить МПС, использовать уже полученные знания. Для удобства учителю необходимо иметь тематическое планирование, где заранее обработаны все учебные пособия, дополнительная литература, указаны МПС, составлены задания для учащихся.
В главе: “Химия элемента углерода и его соединений” рассмотрены вопросы по происхождению углекислого газа, рассмотрены его физические и химические свойства. Углекислый газ имеет широкое применение во всех сферах жизни человека. Проведен химический эксперимент по определению молярной массы углекислого газа, который получали, используя несколько методик. Наилучшего результата, т. е. наименьшей относительной ошибки удалось достичь при разложении гидрокарбоната натрия – 0,31%, при разложении малахита – 1,24%, при традиционном методе взаимодействия мрамора с HCl – 1,5%. Был проведен опыт и по декарбоксилированию лимонной кислоты – Cu – Kat – 3,7%. По полученным данным построена столбиковая диаграмма.
При написании географической главы использовалось огромное количество источников, изучением глобальных проблем, в частности, проблемой парникового эффекта занимается немало ученых. По статистическим данным были построены круговые и столбиковые диаграммы. Сделаны следующие выводы: главными загрязнителями углекислым газом атмосферы являются: ТЭС, авиация, машиностроительные предприятия, транспорт, вулканы и другие мофеты. По количеству углекислого газа на душу населения 1 место у развитых капиталистических стран. Это связано с высоким экономическим развитием стран, мощной ТЭ базой, отлично развитым м/с комплексом, транспортом.
По ходу работы были использованы следующие методы: картографический, статистический, анализ научной и научно-популярной литературы, исследовательский. В работе задействовано более 40 источников.
94
Глава 3. Роль соединений углерода в природе
Не то, что мните вы, природа:
Не слепок, не бездушный лик –
В ней есть душа, в ней есть свобода,
В ней есть любовь, в ней есть язык.
Ф.И. Тютчев
В современных условиях, когда в мире интенсивно развивается промышленность, сельское хозяйство и резко возрастает потребление природных энергетических ресурсов, природа не выдержала хамского, беспощадного отношения к ней и закричала. Закричала так, что похоже услышала все сразу. В своей работе я хочу рассмотреть причины одной из “слезинок” природы, ее характер и способы стирания ее с лица природы.
Итак, человечество встало перед проблемой изменения климата планеты из-за, так называемого, “парникового эффекта”.
3.1 Роль углекислого газа в создании ”парникового эффекта”. Углекислый газ и парниковый эффект.
Что же такое “парниковый эффект”? Существует несколько точек зрения на определение “парникового эффекта”. Рассмотрим некоторые из них. Так, доктор геолого-минеральных наук, профессор В.А. Красилов дает следующее определение:
“Парниковый эффект – разогревание нижних слоев атмосферы – возникает в результате поглощения части теплового излучения поверхности Земли молекулами углекислого газа, водяного пара, метана, хлорфторуглеродов и некоторых других газов.”
И определение, данное в экологическом словаре в учебнике “Экология России”:
“Парниковый эффект – потепление климата на Земле в результате повышения содержания в приземном слое атмосферы углекислого газа, метана, пыли. Смесь пыли и газов действует, как полиэтиленовая пленка над парником: хорошо пропускает солнечный свет, идущий к поверхности почвы, но задерживает рассеиваемое почвой тепло, в результате под пленкой создается теплый микроклимат.”
Однажды на обложке популярного западногерманского журнала “Шпигель” был изображен знаменитый Кельнский собор, со всех сторон окруженный водой. При этом то была не рейнская вода, а морская – итог предсказываемого потепления Земли, попытка наглядно изобразить возможные итоги климатических изменений.
Действительно, некоторые явления последних лет заставляют задуматься: а не началось ли уже это потепление? 1988 год побил все рекорды климатических “ненормальностей”, а целых пять лет в 80-х годах были самыми теплыми за все уходящее столетие. В 1988 году впервые за много десятилетий жара в Нью-Йорке не спадала сорок дней, ртутный столбик не спускался ниже 31°C. Небывалая жара была и в Лос-Анджелесе, но ей предшествовал февраль – необычная для Калифорнии волна холода. Осенью того же года страшный ураган в Карибском море лишил крова 500 тыс. человек только на Ямайке. Суровая засуха летом того же года в США привела к тому, что сбор зерна впервые упал ниже его потребления, экспорт его шел только за счет старых запасов, урожайность зерновых в этом году упала на 1/3 – небывалое в истории устойчивого земледелия США явления. К этому следует добавить, что в том же году 2/3 территории Бангладеш было затоплено в итоге затяжных муссонных дождей, наводнение оставило без крова 25 млн. человек (почти 1/4 населения этой страны). А в Антарктиде от огромного ледового шита шестого континента откололся гигантский айсберг длиной 130 км – предвестник и символ грозящего потепления. Жарко было в эти “ненормальные” годы и в Европе. Директор одного из институтов НАСА (США) предупредил тогда: “Очень вероятно, что тепличный эффект уже действует”.
“Парниковый эффект” или “гринхауз-эффект”.
Миллиарды тонн углекислого газа ежечасно поступают в атмосферу в результате сжигания угля и нефти, природного газа и дров, миллионы тонн метана поднимаются в атмосферу от разработок газа, с рисовых полей Азии (газы полей орошения, образующиеся при гниении органических веществ под действием метанообразующих бактерий в условиях ограниченного доступа воздуха, водяного пара). Все это – “парниковые газы”.
Как видим, в обоих определениях указан главный источник беды – углекислый газ. Не считая выбросов, в атмосфере Земли находится 2,3·1012 т диоксида углерода. Где же может располагаться “природный” и “антропогенный” CO2? Оказывается основные резервуары CO2 – стратосфера и тропосфера, где CO2 равномерно распределен до высоты 7 км, а также глубинные слои океана; временный резервуар – биосфера. В стратосферу в год поступает 2,5·1016 т CO2, в тропосферу – 3,1·1016 т, в перемешиваемый слой океана – 2,0·1016 т. Время задержки в этих резервуарах 40 лет, 2 года и 1 год соответственно.
Из курса биологии мы знаем, что CO2 является источником питания растений – играет огромную роль в фотосинтезе. Так и пусть его будет много. Кругом будет благоухать флора. Так нет, все ученые мира требуют снижения выбросов в атмосферу диоксида углерода. Почему?! По своей химической устойчивости диоксид углерода, в отличие от других газов-загрязнителей, более устойчив в атмосфере, он поглощается гидросферой, расходуется на фотосинтез и выветривание силикатных пород, на постройку кораллов, однако эти регуляторы не могут справиться с техногенными выбросами. Накопление CO2 в атмосфере приведет к потеплению, которому будут сопутствовать таяние полярных льдов, подъем уровня мирового океана, затопление густонаселенных приморских низменностей и целых островных государств, опустынивание, иссушение основных сельскохозяйственных районов Северного полушария. Такого рода опасения были существенно подкреплены обнародованным в 1990 году докладом первой рабочей группы Международного пленума по климатическим изменениям, составленным 170 авторитетными специалистами из 25 стран (и еще 200 ученых были привлечены к рецензированию доклада). По их единодушному мнению парниковый эффект уже дал потепление на 0,3-0,6°С (0,5°C) в конце 19 века. Удвоение содержания CO2 в атмосфере произойдет в 2035 г. Соответствующее глобальное потепление составит по разным оценкам от 1,5°C до 4,5°C, а, скорее всего, около 2,5°C. К этому времени ожидается подъем уровня моря от 8 см до 29 см (около 20 см) и до 65 см к 2100 г. На обширных пространствах Евразии и Северной Америки, включая основные житницы, установится летне-сухой климат.
Обнаружена тесная связь между концентрацией CO2 и температурами в экваториальной области. Оба показателя возрастают и снижаются согласованно, причем изменения концентрации CO2, активно участвующей в создании парникового эффекта, на несколько месяцев отстает от потеплений и похолоданий тропических морей. Отсюда следует, что либо первопричиной краткосрочных вариаций содержания CO2 являются изменения температуры, либо оба явления подвержены влиянию неизвестного метеорологического фактора.
Обнаруженная связь двух параметров подтверждает давно высказанную идею, согласно которой рост температур должен приводить к тому, что поверхность суши и океана отдает часть накопленной ими CO2, что, в свою очередь, способствует новому потеплению.
Научное прогнозирование предполагает ряд наблюдений, исторический материал, на основе которого можно выявить те или иные закономерности. В отличие от него обиходный прогноз представляет собой простую картину в будущее, перенесение современной ситуации вперед. Так, эпизодическое падение уровня Каспия до середины 70-х годов побудило лиц, принимающих решение, перенести предприятия ближе к побережью в ожидании еще большего падения в будущем. В результате современный подъем Каспия привел к много миллиардному ущербу.
Парниковая модель климатических изменений, принимающая в качестве точки отсчета начало нынешнего века и предсказывающая современный уровень техногенного воздействия на атмосферу без учета других факторов, относится к прогнозам последнего типа. В отличие от нее, модели, опирающиеся на исторический материал, прогнозируют природные процессы, которым противостоять невозможно. К ним можно лишь приспособиться ценой больших или меньших потерь.
Урок Каспия показывает, что хозяйственная система, не приспособленная к изменениям природной среды, терпит ущерб не только от негативных, но и от потенциально позитивных изменений, которые она не способна оперативно использовать. Повышение уровня моря могло бы помочь восстановлению утраченных нерестилищ. Потепление позволило бы сократить энергозатраты и повысить продуктивность зерновых. В действительности же любое изменение оборачивается катастрофой. Оптимальная стратегия, по-видимому, заключается не в стремлении любой ценой сохранить status guo, а в адаптации хозяйственной системы к циклическим природным процессам, которые можно прогнозировать на основе исторических данных.
Известно, что в прошлом климат существенно отличался от современного и что природные климатические колебания происходили с определенной периодичностью, проявляющейся, в частности, как чередование ледниковых и межледниковых эпох. Последний ледниковый максимум датирован 18 тыс. лет назад, а мы живем в условиях межледниковья, начавшегося около 11 тыс. лет назад. На фоне этой периодичности происходят относительно кратковременные колебания, подобные малому климатическому оптимуму 1000 лет назад, малому ледниковому периоду 200-250 тыс. лет назад, и еще более мелкие вплоть до 4-5 и 2-х летних циклов. Это исторический материал, позволяющий прогнозировать аналогичные (хотя и не вполне идентичные) колебания в будущем. Точность прогноза зависит от качества информации о климатах прошлого, которое, как было признано на совещании “Климаты прошлого и климатический прогноз” (Москва, институт охраны природы и заповедного дела, 1992 г.), во многих случаях оставляет желать лучшего.
Техногенные воздействия происходят не на статическом, а на динамическом фоне природных процессов. Около 1000 лет назад климат был теплее на 0,5°C. Есть ли основания приписывать современное потепление того же масштаба техногенным газам? По-видимому, нет, так как 40-60 годы, первый этап массовых выбросов CO2 ознаменовались заметным похолоданием. Резко возросшие техногенные выбросы 80-х по сверхточным спутниковым измерениям за десятилетие (1979-1988 гг.) не дали парникового эффекта.
Модели парникового потепления, решая уравнения с множеством неизвестных, не принимают в расчет обратных связей между потеплением и реакцией планетарных систем атмосферы, биосферы и гидросферы – изменения облачности, продуктивности растительных сообществ, циркуляции биологических вод.
Недавно обнаружена несомненная связь между содержанием CO2 в атмосфере и распространением аномально теплых поверхностных вод в Тихом океане, названное Эль-Ниньо, происходящим с периодичностью в 4-5 лет и вызывающим аномальные климатические явления – теплые зимы на Аляске, засухи в Африке – практически по всему шару. Оказалось, что в начале Эль-Ниньо концентрация CO2 уменьшается, а затем увеличивается, превышая техногенную добавку. Спад CO2 можно объяснить подавлением апвеллинга – подъема холодных глубинных вод, выделяющих CO2 в атмосферу, а пик – уменьшением растворимости CO2 при повышении температуры (альтернативный биологический механизм, предполагаемый Дж. Килингом и другими авторами, маловероятен, так как временной интервал колебаний CO2 недостаточен для ощутимой реакции биосферы).
Дальнейшим подтверждением роли океанической циркуляции как основного регулятора содержания CO2 в атмосфере явились ряды наблюдений, показывающих не только хорошую корреляцию CO2 с температурой, но и запаздывание колебаний CO2 на 4 месяца по отношению к температуре поверхностных вод и на 1 месяц по отношению к температуре воздуха. Становится еще более очевидным, что в системе “CO2 – температура” ведущий фактор – температура, а не CO2 и что происходящее увеличение концентрации CO2 (включая техногенный источник) объясняется потеплением, а не наоборот. Эти данные не только вносят существенные коррективы в традиционные представления о роли океана в регуляции газового состава и поддержании теплового баланса атмосферы, но и приближают нас к общему объяснению климатических колебаний. Эль-Ниньо связаны с кратковременными изменениями скорости вращения Земли в результате гравитационных воздействий других небесных тел, которые служат пусковым механизмом волновых процессов в земных оболочках, включая Мировой океан и биосферу.
Известно, что в смене климатических ситуаций ледникового периода выражены циклы прецессий, наклона эклиптики и эксцентриситета земной орбиты. Содержание CO2 в атмосфере геологического прошлого по пузырькам воздуха в льдах Антарктиды, проверенных на станции Восток, коррелирует с температурой ледниковых и межледниковых эпох. Эти данные были использованы для подтверждения парниковой модели. Однако и здесь возникает вопрос о причинах и следствиях. Поскольку техногенного источника не было, то остается биосфера, продуктивность которой в межледниковье возрастала (сток, а не приток CO2), и океан, повышение температуры которого, по-видимому и было основным источником CO2.
Среди более отдаленных геологических периодов определенный интерес представляет меловой – 130 – 65 млн. лет назад. Постоянных полярных льдов в меловом периоде не было (хотя могли быть сезонные). Составленные фитоклиматические схемы дают представления о климатической зональности безледниковой планеты и позволяют сделать некоторые выводы прогнозного характера. Экваториальная зона примерно в современных границах отличалась сухостью и температурой ниже современной (крайний ксероморфизм растений, хвойные в низинных растительных формациях).
Область преимущественного распространения жестколистных кустарниковых формаций, интерпретируемая как зона летне-сухого климата, простиралась до 50° с. ш. в Азии, и на западе Северной Америки. На атлантическом побережье ее северная граница поднималась до 60°. Данные по годичным кольцам прироста древесины и склеритам на чешуе рыб указывают на непродолжительный сухой сезон. Вместе с тем, к этой зоне приурочены самые крупные захоронения меловых динозавров, свидетельствующие о высокой продуктивности жестколистной растительности.
Зона листопадных лесов простиралась далеко за полярный круг, по крайней мере до 80°с. ш. В ее пределах намечалась незначительная дифференциация по содержанию теплолюбивых компонентов, причем на полярных широтах снова возрастала роль вечнозеленных растений и, судя по количеству месторождений, численности динозавров, остатки которых известны на Шпицбергене, северной Камчатке, северном склоне Аляски.
По общей продуктивности меловая растительность едва ли существенно отличалась от современной, так как слабая облесенность экваториальной зоны могла компенсироваться полярными лесами. Вместе с тем мощный вулканизм мелового периода, в десятки раз превышавший современную вулканическую активность, служил источником парниковых газов, не уступавшим техногенному.
Таким образом, мы подошли ко второму разделу, доказав, что в создании парникового эффекта играют роль как природные так и антропогенные источники.
3.2 Основные загрязнители атмосферы
3.2.1 природные источники
При извержениях вулканов вместе с лавой из них изливается и углекислый газ в таком изобилии, что после одного извержения Везувия им было задушено тысячи зайцев и других маленьких животных. В то же время колодцы и погреба в Неаполе, далеко отстоящем от вулкана оказались наполненными углекислым газом. Углекислый газ постоянно выделяется сильными струями из почвы даже в таких местностях, где вулканическая деятельность давно прекратилась.
Сколько столетий функционирует в качестве постоянно действующего генератора углекислого газа неаполитанская “Собачья пещера”, без упоминания о которой не обходился ни один учебник химии и географии, вряд ли можно определить это; “чудо природы” упоминалось не только Ван-Гельмгольтом, но и в “Естественной истории” Плиния, созданной в начале нашей эры. Такие же пещеры существуют в Иеллоустонском заповеднике (США). Птицы и насекомые, залетающие в них в поисках убежища, гибнут. Громадные количества углекислого газа доставляются из недр Земли в атмосферу и ключами, изливающимися в местностях, где действуют или когда-то действовали вулканы.
Природные источники углекислого газа называются мофетами. Мофеты характерны для последней, поздней стадии затухания вулканов, в которой находится в частности знаменитый кавказский вулкан Эльбрус. Поэтому там наблюдаются многочисленные выходы пробивающихся сквозь снега и льды горячих источников, насыщенных углекислым газом. Наиболее известные из минеральных источников (углекислотных) находятся в Кисловодске (Назран), где они используются в лечебных целях (лечение желудочно-кишечного тракта).
Вне земного шара углекислый газ обнаружен спектроскопическим путем в атмосфере Венеры. Атмосфера ближайшей к Земле планеты лишена кислорода и водяных паров и полностью состоит из углекислого газа. При атмосферном давлении, составляющем около половины давления, господствующего на нашей планете, и средней температуре около 70°C Венера являет нам, примерный вид Земли, какой она была до появления на ней растительного покрова.
3.2.2 авиация
Группа Л. Майкелис – управление энергетических технологий, Харуэлл, Великобритания (ж. “Природа” № 2, 1993г.) пересмотрела выводы о поступлении парниковых газов в атмосферу, сделанные в 1990 году Межправительственной комиссией по изменению климата.
По их мнению: самолеты способствуют парниковому эффекту в восемь раз сильнее автомашин и в 22 раза больше, чем междугородний электрический железнодорожный транспорт. На каждое пассажирское место в самолете “приходится” 684 грамма углекислого газа на 1 км проделанного пути, на одного пассажира легковой машины, прошедшего то же расстояние – лишь 83 грамма, а скоростного электропоезда – 31 грамм. Так из таб. 1 видно, сколько выбрасывается углекислого газа в двигателях космического корабля “Шаттл” за 1 полет.
| продукты сгорания, кг | высота приземного пограничного слоя | тропосфера | стратосфера |
|
CO2 |
0 – 0,5 | 0,5 – 1,3 | 13 – 50 |
| 55075 | 172570 | 147684 |
Таблица 1, Количество углекислого газа в слоях атмосферы.
Особое беспокойство вызывает большое оксидов азота, выделяемых авиадвигателями во время полетов на высоте 10-12 км. Подвергаясь там фотохимическим реакциям, этот газ образует озон, порождающий парниковый эффект. На уровне Земли 1 грамм газа по воздействию втрое превосходит то же количество углекислого газа, а в верхних слоях атмосферы в 335 раз больше. В первую очередь это связано с более низкими температурами верхней атмосферы, замедляющими химические реакции и тем самым парниковое воздействие таких, как озон, газов со сравнительно коротким сроком “жизни”.
Выбросы оксидов азота ответственны примерно за 2/3 всех поставляемых самолетом парниковых газов; остальные на “совести” углекислого газа. Наибольшее воздействие на температуру Земли, имеет озон, находящийся на высоте около 12 км, где проходит основная часть самолетов.
Таким образом, хотя самолеты в Европе производят видимо, не более 3% выброса оксидов азота, их вклад в парниковый эффект равен вкладу всех иных источников этого газа. Проблема усугубляется быстрым ростом авиасообщений: количество самолетов, садящихся или взлетающих, например, в аэропортах Великобритании, за последние 20 лет удвоилось.
Но проблему уже пытаются решать. Как известно, основная часть оксидов азота авиапроисхождения образуется в двигателе при температуре 1700°C. Ведущая авиастроительная компания “Роллс-Ройс” (Великобритания) начала разрабатывать двигатель, сжигающий топливо в несколько этапов – без высоких температур, но с прежней эффективностью.
До сих пор авиаконструкторы, повышая эффективность в расходовании горючего, шли по пути увеличения давления и температур, в результате выброс углекислого газа сократился, но возросло поступление в атмосферу оксидов азота. По оценкам специалистов, полная смена концепций и налаживания выпуска экологически чистых самолетов потребует не только больших затрат, но и длительного времени.
3.2.3 машиностроительное предприятие
Современное машиностроение развивается на базе крупных производственных объединений, включающих заготовительные и кузнечно-прессовые цехи, цехи термической и механической обработки металлов, цехи покрытий и крупное литейное производство.
Наиболее крупными источниками пыле- и газовыделения в атмосферу в литейных цехах являются вагранки, печи, участки складирования и переработки шихты.
Газовыделения углекислого газа при заливке металлом форм и их охлаждении можно определить по данной таблице 2.
вещество |
удельные газовыделения для марки связующего вещества мг/кг смеси·час |
||
| ОФ - 1 | БС - 40 | УКС | |
|
диоксид углерода CO2 |
688 | 3260,0 | 8563,0 |
| для сравнения оксид углерода CO | 920,0 | 496,0 | 1921,0 |
Примечание:
1. ОФ-1, БС-40, УКС – это смолы для скорейшего затвердевания состава.
2. 80% газовыделения всех вредных веществ приходится на первые 20 минут после заливки металла в формы.
3.2.4 ТЭС
Ежегодно в окружающую среду нашей планеты поступает до 2·1020 Дж теплоты, что сопровождается выбросом в атмосферу 18·109 тонн углекислого газа. Основными источниками тепловых выбросов являются процессы сжигания органического топлива (нефти, газа на ТЭС) и объекты ядерной энергетики (АЭС). Тепловые выбросы приводят к росту среднегодовой температуры атмосферы на Земле, снижению снежно-ледяного покрова и, как следствие, к уменьшению отражательной способности (альбедо) планеты. Все это стимулирует дальнейшее повышение средней температуры земной поверхности. По данным Национальной академии наук США, к середине 21 века температура атмосферы Земли возрастет примерно на 5,5°C. Поэтому за счет таяния ледников и полярных льдов в ближайшие 25 лет ожидается повышение уровня Мирового океана на 10 см.
Анализ выбросов теплоты в атмосферу от совокупности промышленных объектов на региональном уровне показывает, что характерно наличие регионов с тепловыделением от 10-20 Вт/м2 площадью до 104 км2.
3.2.5 транспорт
Автотранспорт также является источником загрязнения атмосферы, количество машин непрерывно возрастает особенно в крупных городах; а вместе с тем растет валовой выброс вредных продуктов в атмосферу. Автотранспорт в отличие от промышленных предприятий относится к движущимся источникам загрязнения.
Токсическими выбросами ДВС (двигателя внутреннего сгорания) являются отработавшие и картерные газы, пары топлива из карбюратора и топливного бака.
Основная доля токсичных примесей поступает в атмосферу с отработавшими газами ДВС. Исследования состава отработавших газов ДВС показывают, что в них содержится несколько десятков компонентов, некоторые из них в таблице 3.
| компоненты | содержание компоненты, объем доли, % | примечание | |
|
CO2 N2 CO CnHm |
5,0-12,0 74-77 0,5-12,0 2,0-3,0 |
1,0-10,1 76,0-78 0,01-0,50 0,009-0,5 |
нетоксичны токсичны |
В целом 50% выбросов диоксида углерода в мире поставляет электроэнергетика, 1/4 – промышленность, 1/5 – транспорт.
3.3 Борьба с выбросами углекислого газа и их учет
Первой страной, выступившей с заявлением о готовности сократить выбросы парниковых газов была Великобритания. Ее примеру последовали и другие страны. На переговорах по климатической конвенции наиболее решительную позицию заняли Скандинавские страны, Нидерланды, Швейцария (заявившая о сокращении выбросов углекислого газа на 2,5% к 2000 г.), ФРГ, Франция, Союз малых островных государств. Меньше энтузиазма проявили США, Канада, Россия, Япония, Саудовская Аравия.
Для борьбы с выбросами углекислого газа в атмосферу прибегают за помощью к процессам очистки и обезвреживания технологических и вентиляционных выбросов. Процессы эти различны, значит различны и способы очистки, так как:
1. газы, выбрасываемые в атмосферу вместе с углекислым газом, весьма разнообразны по своему составу.
2. имеют высокую температуру и содержат большое количество пыли, что затрудняет процесс очистки и требует дополнительной подготовки отходящих газов.
3. концентрация газа в вентиляционных и реже технологических выбросах обычно переменна и низка.
Для того, чтобы бороться с выбросами нужно точно знать присутствует интересуемый нас газ в выбросах или нет. И для этого создан высокочувствительный детектор для измерения углекислого газа.
Обычно надежность измерений содержания в атмосфере углекислого газа, играющего столь важную роль в создании парникового эффекта, снижает присутствие в воздухе водяных паров. По-видимому, японским химикам Н.Мидзуно и М.Ивамото (Хоккайдский университет, Саппоро) удалось создать детектор, устраняющий этот недостаток. Ранее в Японии велись эксперименты с порошком оксидов металлов, электрическое сопротивление которых изменяется в случае, когда диоксид углерода адсорбируется на их поверхности. Еще в 1990 г. группа под руководством Н.Ямадзо (Университет Кюсю) показала, что сопротивление порошкообразного оксида олова, помещенного между платиновыми электродами, возрастает при его продувке смесью углекислого газа с гелием при температуре 100°C. Аналогичный эффект наблюдался с использованием бария. Однако во всех этих случаях чувствительность к углекислому газу была незначительной и еще более ослабевала в присутствии водяных паров.
Позже было установлено, что высокой чувствительностью к углекислому газу обладает смесь индия с оксидами кальция, позволяющая хорошо идентифицировать этот парниковый газ даже в присутствии паров воды. Оксид индия получали путем гидролиза хлорида индия в присутствии раствора аммиака; осадок нагревали до 850°C. Полученное вещество еще активнее реагировало на углекислый газ, если к нему добавляли примерно 5% оксида кальция. Изготовленный на этой основе детектор оказался в состоянии измерять концентрации углекислого газа, не превышающие 2 тыс. частей на 1 млн. даже в присутствии 1,8% водяных паров.
Таким образом, способность оксида индия реагировать на малые концентрации углекислого газа связана с присутствием иных оксидов, причем оксид кальция повышает чувствительность в наибольшей степени; далее следуют оксиды стронция и бария; оксиды металлов – никеля, магния и калия – вполовину, а цинка, натрия, празеодима и неодима в 10 раз менее чувствительны.
Есть надежда на создание приборов, способных с большой точностью регистрировать наличие в атмосфере углекислого газа.
Очистка и последующая утилизация углекислого газа проходит через различного рода фильтры. Прибегают также и к рассеиванию выбросов.
Для контроля в России используются следующие приборы (табл. 4).
тип прибора |
метод измерения | определяемое вещество |
измеряемая концентрация, мг/м3 |
погрешность,% |
| ФЛ-5601 | фотоколориметрический | углекислый газ | 0-20 |
±10 |
| КУ-3 | кондуктометрический | углекислый газ | 0-500 |
±5,0 |
| ГАИ-2 | оптикоабсорбционный | углекислый газ | 0-5 |
±4 |
В России ПДК (предельно допустимой концентрации) по содержанию углекислого газа не установлено, в США – 9000 мг/м3. Благодаря строгому учету нарушений ПДК и высоким штрафам в США выбросы углекислого газа на 1 млрд. долларов национального продукта за последние 10 лет уменьшились с 470 до 350 тыс. м3. Сокращение выбросов углекислого газа на 60% обойдется примерно в 2·1012$.
В ФРГ валовый национальный продукт с 1973 г. по 1985 г. увеличился на 26%, а выбросы углекислого газа сократились на 11%.
3.4 Океаническая вода как пожиратель углекислого газа
Согласно подсчетам специалистов, примерно на 60% углекислого газа, ежегодно поступающего в атмосферу Земли, надолго остается в воздушном пространстве, способствуя парниковому эффекту, остальное количество поглощается на суше и в Мировом океане. Однако механизм и активные участники этого процесса все еще вызывают дискуссии среди специалистов.
Недавно группа сотрудников Плимутской морской лаборатории (Великобритания) во главе с Уотсоном исследовала влияние скоплений планктона в северо-восточной части Атлантического океана на поглощение углекислого газа его поверхностными водами. Как показали измерения, это влияние очень существенно, причем содержание углекислого газа в воде, обусловленное активностью этих микроорганизмов, может различаться на 10% в пунктах, отстоящих друг от друга всего на 20 км. Все прежние оценки интенсивности поглощения углекислого газа Мировым океаном не учитывали подобный биологический фактор и, следовательно, были ошибочны. В течение длительного времени специалисты основным поглотителем углекислого газа считали Южный океан, и лишь в 1990 г. появились свидетельства, что и в Северном полушарии существуют районы, где этот процесс идет весьма активно.
Процесс растворения углекислого газа – в приложении 13.
Колоссальное значение океана состоит и в том, что он, будучи “легкими” планеты, пробуцирует своим фитопланктоном почти половину всего кислорода атмосферы. В обменном процессе между атмосферой и океаном, то есть в “дыхании” океана участвует 100 млрд тонн CO2. При этой жизнь, населяющая океан, ассимилирует в год в среднем 126 млрд. тонн CO2. Против 20 млрд. тонн, ассимилируемых жизнью суши. Океан, как насос, поглощает своими холодными водами CO2 в полярных широтах и отдает его в нагретых экваториальных и тропических зонах. Именно поэтому давление CO2 в области тропиков всегда несколько выше, чем в высоких широтах. Мировой океан как среда жизни представляет интерес прежде всего потому, что именно здесь, по мнению многих ученых, зародилась жизнь, которая в длительном процессе эволюции дала колоссальное многообразие форм. Разнообразие форм жизни на земле поразительно, хотя оно основано на одном типе химического процесса – фотосинтезе, в результате которого в растениях из неорганических веществ создается органическое. Большое часть растительного мира океана это микроскопические фитопланктоновые организмы прикрепленные ко дну водные растения занимают очень небольшую часть), которые в основном и являются первичной продукцией моря. Объем ежегодной продукции фитопланктона в Мировом океане оценивается величиной 500 млрд. тонн. На основе первичной продукции развиваются все другие морские организмы – бактерии, зоопланктон, рыбы, морские звери. Для развития фитопланктона кроме энергии солнечного света необходимы неорганические компоненты. В состав организмов входит до 60 химических элементов, однако 90–95% массы организмов состоит из 6 элементов, называемых биофильными (жизнелюбивыми) или биогенными. Это углерод, кислород, водород, фосфор, кремний.
Схема обмена углерода между его соединениями в океане
Атмосфера
![]() CO2
CO2
![]()
![]()
![]()
![]()
![]()
![]()
![]() водные
CO2
H2CO3
HCO3-
CO32-
водные
CO2
H2CO3
HCO3-
CO32-
![]()
![]()
![]() растения
растения
![]()
![]()
растворенные
органические вода
вещества
![]()
![]()
![]()
![]() остатки
животные
CaCO3 CaCO3
остатки
животные
CaCO3 CaCO3
![]() организмов
крист.
раст.
организмов
крист.
раст.
![]()
![]()
![]()
![]()
![]()
органические CaCO3 тв. CaCO3 тв.
вещества
На больших глубинах, где фотосинтез из-за недостатка света прекращается, идет образование CO2 за счет разложения органического вещества в результате распада. В верхнем 500 метровом слое окисляется в среднем до 87% первичной продукции. В донные осадки попадает 0,1% органического вещества. В океане ежегодно оседает все вносимое реками количество гидрокарбонатов 1,7 млрд. тонн кальция (0,5 млрд. тонн) и частично магния (0,36 млрд. тонн).
3.5 Неравномерное потребление углекислоты наземными системами.
Почвы – один из важнейших природных ресурсов, который человечество активно использует с незапамятных времен. Почвы, почти сплошным ковром покрывающие поверхность земной суши, представляют собой как бы “кожу Земли”, которая предохраняет горные породы от интенсивного разрушения. Почвы – не просто субстрат, на котором растут растения, в них происходят активные биологические, химические и физические процессы, регулирующие обмен веществом и энергией между литосферой, гидросферой, атмосферой. Распределение почв, как и многих других биологических систем, подчиняются закону природной зональности, во многом связанной с климатическими параметрами. Как же поведут себя почвы в условия парникового эффекта? Потеряют ли черноземы свое плодородие? Что будет с тундровыми почвами, формирующимися на вечной мерзлоте, если она оттает на большую глубину? Будет ли скорость изменения почв равна скорости изменения климата? Как в условиях нарастающего парникового эффекта проявятся изменения почв связанные с другими антропогенными воздействиями на природу – ирригаций, сведением лесов, добычей полезных ископаемых, кислотными осадками?
Опыта по изучению данной проблемы мало. Но ясно, что локальные изменения передаются на почвы смежных территорий через поверхностные и грунтовые воды, однако со значительно меньшей скоростью и на меньшие пространства, нежели это имеет место в других природных средах (в воздухе, в воде).
Наиболее существенные сдвиги будут наблюдаться, видимо, в почвах северных широт где по прогнозам, потепление климата и увеличение осадков значительно превысят соответствующие средние и глобальные.
В тундре и лесотундре (севернее 70°с.ш.) где ожидается, что средняя температура поднимется на 4-5°C (главным образом за счет зимних температур) и возрастет количество осадков (на 50-100 мм) границы лесотундры и северной тайги начнут медленно сдвигаться к северу, значит на щебнистых и песчаных грунтах усилятся процессы подзолообразования, а на тяжелых глинистых породах, особенно в низинах – глеевые процессы или заболачивание.
В таежной зоне Восточной Сибири могут усилиться протаивание почв и грунтов, а также подзолистый процесс на равнинах в легких почвах, заболачивание полей, расширение термокарстовых и солифлюкционных явлений, приводящих к механическому перемещению почв, оползням, просадкам.
В южной тайге ожидается потепление зимой и летом на 2-3°C с одновременным уменьшением количества осадков (до 25 мм). Можно представить, что в хвойных лесах с подзолистыми почвами соответственно появятся широколиственные породы и кустарники, усилится дерновый процесс в почвах, и они приблизятся к серым лесным. На дерново-подзолистых почвах сельскохозяйственных угодий количество влаги может заветно снизиться.
В лесостепной зоне серых лесных почв, оподзоленных, выщелоченных и типичных черноземов – главной сельскохозяйственной зоне – прогнозируют некоторое потепление (на 1-2°C)и уменьшение осадков на 15-20 мм. В связи с этим в почвенном покрове весьма вероятна тенденция эволюции лугово-черноземных и черноземовидных луговых почв в черноземы, а в плакорах – за счет непромывного водного режима в последних – повысится уровень карбонатов. Усиление сухости климата в лесостепной зоне потребует в сельскохозяйственном производстве активизации мероприятий по сохранению влаги в почвах, а вероятнее всего – расширение орошаемого земледелия.
Конечно, этот прогноз основывается на ожидаемых климатических изменениях. Между тем в последние десятилетия наблюдается пока не нашедший объяснения медленный подъем уровня почвенно-грунтовых вод в Черноземной зоне Средней России и Украине, расширение площади так называемых “мочалистых” переувлажненных почв. Эти факты свидетельствуют о сложности динамики гидрологических режимов в почвах и ландшафтах, о многообразии причин их изменений, а значит, и о трудностях долговременных прогнозов.
В зонах степных черноземов и сухостепных каштановых почв с повышением среднегодовых температур на 1-2°C и с очень незначительным увеличением годовых осадков не следует ожидать изменения активности почвенной биоты и ухудшения водно-физических свойств почв; возможны локальные процессы осолонцевания почв и некоторой аридизации ландшафтов.
В полупустынной зоне светлокаштановых и бурых почв Прикаспийской низменности ожидается наряду с потеплением климата, увеличение атмосферных осадков примерно на 100 мм, что существенно усилит увлажнение почв и растительности в этой зоне. Скорее всего здесь, в типчаково-полынных и полынно-солянковых фитоценозах, постепенно возрастает количество злаков и в целом растительность пастбищных угодий улучшится, но только при разумном и бережном хозяйствовании.
В пустынях Казахстана и Средней Азии песчаные пустынные почвы, возможно, полнее покрываются злаково-кустарниковой растительностью и продлиться период ее вегетации. В почвах глинистых пустынь весьма вероятно увеличение пестроты почвенного покрова за счет перераспределения солей по элементам мезо- и микрорельефа.
3.6 Выводы
В ходе работы выяснилось, что совсем нетоксичный оксид углерода (IV), то есть CO2 является нарушителем всего живого и неживого в природе.
В 20 веке наблюдается рост концентрации CO2 в атмосфере, доля которого с начала века увеличилась почти на 25%, а за последние 40 лет на 13%. Оценим вклад России в увеличение концентрации CO2 в атмосфере. Данные по выбросам CO2 в результате сжигания ископаемого топлива в России получены из данных по бывшему СССР, вклад которого в выбросы CO2 весьма значителен (таблица 6).
Выбросы углерода разными странами в 1960 и 1987 гг.
| Выбросы углерода по годам | ||||||
| страна | всего, млн. т | на 1 $ ВНП, г | на 1 человека, г | |||
| 1960 | 1987 | 1960 | 1987 | 1960 | 1987 | |
| США | 791 | 1224 | 420 | 276 | 4,38 | 5,03 |
| СССР | 396 | 1035 | 416 | 436 | 1,85 | 3,68 |
| Китай | 215 | 594 | - | 2024 | 0,33 | 0,56 |
| Великобритания | 161 | 156 | 430 | 224 | 3,05 | 2,73 |
| ФРГ | 149 | 182 | 410 | 223 | 2,6668 | 2,98 |
Примечание: Германия без восточной части.
По объему выбросов углерода (1 тонна углерода соответствует 3,7 тонны углекислого газа) первое место принадлежит США, затем страны Европейского экономического сообщества, а далее бывший СССР. Эти страны дали более половины выбросов, так как в России производится примерно 80% получаемой ранее в СССР продукции, ее вклад в выбросы CO2 в атмосферу весьма велик и составляет порядка 800 млн. тонн углерода, или около 3 млрд. тонн CO2, следовательно, на каждого жителя приходится несколько меньше 13% общей массы выбрасываемого в атмосферу углерода, на долю США более 20%, на долю ЕЭС – около 20%, на долю Китая немногим более 11%. Таким образом, вклад хозяйства России в возможный парниковый эффект весьма значительный.
Экологи предупреждают, что если не удастся уменьшить выбросы в атмосферу CO2, то нашу планету ожидает катастрофа. Сегодня остается нерешенной мировая проблема энергии и CO2.
Нерешенные проблемы в мире: энергия и углекислый газ.
![]()

![]()
выбросы CO2,
![]() в
млрд. т
в
млрд. т
 мировые
мировые
![]() потребления
потребления
 энергии,
в
энергии,
в

![]() млрд.
т
млрд.
т
![]() нефти
нефти

![]()
![]()
Эмиссия углекислого газа обусловлена энергией на душу населения в этих странах. Данные за 1986 г. в т. CO2:
![]() ГДР
21,2
ГДР
21,2
![]() США
19,7
США
19,7
![]() Канада
17,0
Канада
17,0
![]()
![]() Россия
13,2
Россия
13,2
Польша 12,7
![]()
![]() Великобритания
11,9
Великобритания
11,9
ФРГ 11,7
![]() Япония
7,5
Япония
7,5
![]() Франция
6,9
Франция
6,9
![]() Италия
6,4
Италия
6,4
![]() Китай
1,9
Китай
1,9
![]() Индия
0,7
Индия
0,7
В среднем в мире – 3,88
Источники загрязнения:
сжигание горючих ископаемых сопровождается выбросом 5 млрд. тонн CO2 в год. В результате этого за 1860-1960 содержание CO2 увеличилось на 18% (0,027 до 0,032%). За 1961-1991 темпы этих выбросов значительно возросли. При таких же темпах к 2000 году количество CO2 в атмосфере составит не менее 0,05%.
Библиография
1. Ахметов Н.С. Неорганическая химия. Учеб. пособие для учащихся 8–9 кл. шк. с углуб. изучением химии. В 2-х частях – ч. 1, ч. 2, – 2-е изд. – М.: Просвещение, 1990 – 208 с.
2. Ахметов Н.С. Общая и неорганическая химия. Учеб. пособие для ВУЗов, М.: Высшая школа, 1988 – 470 с.
3. Бабич Л.В., Балезин С.А., Гликина Ф.Б., Зак Э.Г. Практикум по неорганической химии. Учеб. пособие для ВУЗов, М.: Высшая школа, 1989 – 300 с.
4. Барабаш Ц.И. “Использование МПС для формирования у учащихся основ диалектико-материалистического мировоззрения”, ж. “Химия в школе”, 1982, № 3, с. 15.
5. Башлак А.Т. “Что может зажечь углекислый газ”, ж. “Химия в школе”, 1991, № 5, с. 58.
6. Белов С.В., Барбинов Ф.А., Козьеков А.Ф. Охрана окружающей Среды. Учеб. для техн. спец. ВУЗов, под ред. Белова С.В., 2-е изд. и доп. – М.: Высшая школа, 1991 – 319 с.
7. Богдановский Г.А. Химическая экология. Учеб. пособие. М.: Московский Университет, 1994 – 240 с.
8. Боголюбова З.К. Лекции по МПХ, 1993 – 1995.
9. Большая Советская Энциклопедия, т.18, 1974, с. 330.
10. Вишневский Л.В. Под знаком углерода. М.: Просвещение, 1983 – 100 с.
11. Воробьев А.Ф., Дракин С.И. Практикум по неорганической химии. М.: Химия, 1984, 151 с.
12. Вредные химические вещества. Под общей ред. д. биол. н., проф. Филова В.А., Л.: Химия, 1988.
13. Гаркунов В.П., Николаева Е.Б. “Межпредметные связи при проблемном изучении химии”, ж. “Химия в школе”, 1982, № 3, с. 28.
14. Гладкий Ю.Н., Лавров С.Б. Дайте планете шанс!. Книга для учащихся. М.: Просвещение, 1995 – 207 с.
15. Глинка Н.Л. Общая химия. Учеб. пособие для ВУЗов, 22-е изд. исп. Под ред. Рабиновича В.А., Л.: Химия, 1982 – 720 с.
16. Дюсюпова Л.З. “О связи преподавания органической химии с физикой”, ж. “Химия в школе”, 1981, № 4, с. 38.
17. А.Г. Джексон, М.Р. Гримметт. Общая органическая химия. Книга “Азотсодержащие гетероциклы”. Перевод с англ. д. х. н. Кондратьевой и проф. Вульфсона под ред. ак. Кочеткова, М.: Химия, 1985, т. 8.
18. Ерыгин Д.П., Орлова Л.Н. “МПС в процессе изучения химии в 8 классе”, ж. “Химия в школе”, 1982, № 3, с. 23.
19. Ерыгин Д.П., Шишкин Е.А. Методика решения задач по химии. Учеб. пособие для студентов пед. ин-тов по биологии и химии, М.: Просвещение, 1989, 179 с.
20. Зуева М.В., Иванова Р.Г., Каверина А.А. и др. Обучение химии в 9 классе. Пособие для учителя. Под ред. Зуевой М.В. – М.: Просвещение, 1990 – 176 с.
21. Корчагина В.А. Биология: растения, бактерии, грибы, лишайники. Учеб. 6 – 7 кл. ср. шк. – 23-е изд. М.: Просвещение, 1992 – 256 с.
22. Криксунов Е.А., Пасенчик В.В., Сидорин А.П. Экология России. Учеб. для 9 – 11 кл. общеобр. шк. – М.: АОМДС, ЮНИСАМ, 1995 – 232 с.
23. Криксунов Е.А., Пасенчик В.В., Сидорин А.П. Экология. Учеб. пособие для учащихся 9 кл. – М.: Дрофа, 1995 – 240 с.
24. Г. Лукс. Экспериментальные методы в неорганической химии. М.: Мир, 1965 – 365 с.
25. Максимова В.Н. “МП семинар “Биогенные элементы в периодической системе Д.И. М.””, ж. “Химия в школе”, 1981, № 2, с. 26.
26. “Методические пути реализации МПС курса химии с биологией в обучении и внеклассной работе”. Часть 1. Планирование МПС. Часть 2. Оптимизация уроков химии средствами МПС. Рекомендации подготовлены Зайцевым М.А., ассистентом кафедры химии КГПИ им. В.И. Ленина и Койковой Р.С., доцентом кафедры химии КГПИ им. В.И. Ленина, Киров, 1993.
27. Минченков Е.Е. “МПС неорганической химии и физики”, ж. “Химия в школе”, 1981, № 2, с. 22.
28. Миркин Б.М., Наумова Л.Г., Экология России. Учебник для 9–11 кл., М.: Юнисам, 1995.
29. Назаренко В.М. “Экологизированный курс химии от темы к теме”, ж. “Химия в школе”, 1994, № 4, с. 24.
30. Оганесян Э.Т. Руководство по химии. М.: Высшая Школа, 1991 – 200 с.
31. Михайло Ломоносов: Жизнеописание. Избранные труды. Воспоминания современников и суждения потомков. Стихи и проза о нем. Составили Павлова Г.Е., Орлов А.С., М.: Современник, 1989 – 493 с.
32. Пак М.С. “Из опыта использования тестовых заданий”, ж. “Химия в школе”, 1993, № 2, с. 41.
33. Покровский О.С., Савенко В.С. “Экспериментальное моделирование осаждения карбоната кальция в морской воде в условиях фотосинтеза”, ж. “Океанология”, МАИК “Наука”, т. 35, № 6, ноябрь – декабрь 1995, с. 883.
34. Протасов М.В., Молчанов А.В. Экология, здоровье, природопользование в России. М.: Финансы и статистика, 1995.
35. Рудзитис Г.Е., Фельдман Ф.Г. Химия: органическая химия. Учеб. для 10 кл. ср. шк. – М.: Просвещение, 1991 – 160 с.
36. Рябинович В.А., Хавин З.Я. Краткий химический словарь. Л.: Химия, 1978.
37. Сборник программ для общеобразовательных учреждений Российской Федерации 8 – 11 кл. Химия, М.: Просвещение, 1995.
38. Смирнов В.И. Геология полезных ископаемых, М.: Недра, 1969 – 640 с.
39. М.В. Сарджент, Т.М. Крест, О.Мет-Кон, Р. Ливингстон. Книга “Кислородсодержащие гетероциклы”, Перевод с англ. д. х. н. Л.И. Беленького под ред. Кочеткова, М.: Химия, 1985, т.9.
40. Химия. Справочный материал под редакцией академика Третьякова Ю.Д., М.: Просвещение, 1993.
41. Ходаков Ю.В. Общая и неорганическая химия. Пособие для учителей. М.: Просвещение, 1965 – 704 с.
42. Фельдман Ф.Г., Рудзитис Г.Е. Химия. Учеб. для 9 кл. ср. шк. – М.: Просвещение, 1990 – 176 с.
43. Цузмер А.М., Петришина О.Л. Биология: человек и его здоровье. Учеб. для 9 кл. ср. шк. под ред. Загорской В.Н., 19-е изд. – М.: Просвещение, 1990 – 240 с.
44. Энциклопедический словарь юного химика. М.: Просвещение, 1990.
43
Введение
Свою дипломную работу хочу начать со слов ученого-земляка М.В. Ломоносова, которые являются эпиграфом данной работы:
“Вольность и союз наук необходимо требуют взаимного сообщения и беззавистного позволения в том, что кто знает упражняться. Слеп физик без математики, сухорук без химии”.
Перед собой поставила следующие цели:
1. Проследить и изучить межпредметные связи в школьном курсе химии.
2. Подготовить тематическое планирование с взаимными связями в курсе химии-9 с географией, биологией.
3. Ознакомиться с методами и путями реализации межпредметных связей.
4. Опробовать межпредметные связи в различных формах (типы: урок, семинар, викторина, конференция) на педагогической практике 4-5 курса и провести анализ работы.
5. Изучить историю открытия углекислого газа, его химические, физические свойства.
6. Провести эксперимент по определению молярной массы углекислого газа используя для его получения несколько методик. Дать ответ в виде столбиковых диаграмм об относительной ошибке определения. Выявить наиболее доступный способ его получения в условиях лаборатории университета относительно наличия химических реактивов, условий протекания химической реакции, наличия химической посуды.
7. Изучить одну из глобальных проблем человечества – “парниковый эффект” или “эффект гринхауз” (зеленый дом) и роль углекислого газа в его создании.
8. Изучить процесс поглощения водами Мирового океана атмосферного углекислого газа и образование карбонатных отложений.
9. Изучить реакцию наземных и морских экосистем к возникновению и развитию парникового эффекта.
10. Изучить возможные пути разрешения данной экологической проблемы.
11. Проследить при этом взаимосвязь химических процессов и географии.
Глава 1. Межпредметные связи в курсе школьного предмета химии на примере углерода и его соединений
Что же представляют из себя межпредметные связи?
Межпредметные связи – это современный принцип обучения в средней школе. Он обеспечивает взаимосвязь предметов естественнонаучного и естественно-гуманитарного циклов и их связь с трудовым обучением школьников.
По определению Д.П. Ерыгина: “Межпредметные связи можно рассматривать как дидактическую систему, которая отражает в школьных курсах объективно существующие взаимосвязи, обеспечивает посредством согласованного взаимодействия ее учебных компонентов осуществления целенаправленного процесса обучения школьников”.
Использование межпредметных связей – одна из наиболее сложных методических задач учителя химии. Она требует знания содержания программ и учебников по другим предметам. Реализация межпредметных связей в практике обучения предполагает сотрудничество учителя химии с учителями других предметов.
Учитель химии разрабатывает индивидуальный план реализации межпредметных связей в курсе химии. Методика творческой работы учителя в этом плане проходит следующие этапы:
1. Изучение программы по химии, ее раздела “Межпредметные связи”, программ и учебников по другим предметам, дополнительной научной, научно-популярной и методической литературы;
2. Поурочное планирование межпредметных связей с использованием курсовых и тематических планов;
3. Разработка средств и приемов реализации межпредметных связей на конкретных уроках (формулировка межпредметных познавательных задач, домашних заданий, подбор дополнительной литературы для учащихся, подготовка необходимых учебников и наглядных пособий по другим предметам, разработка методических приемов их использования);
4. Разработка методики подготовки и проведения комплексных форм организации обучения (обобщающих уроков с межпредметными связями, комплексных семинаров, экскурсий, занятий кружка, факультатива по межпредметным темам и т.д.);
5. Разработка приемов контроля и оценки результатов осуществления межпредметных связей в обучении (вопросы и задания на выявление умений учащихся устанавливать межпредметные связи).
Планирование межпредметных связей позволяет учителю успешно реализовать их методологические, образовательные, развивающие, воспитательные и конструктивные функции; предусмотреть всё разнообразие их видов на уроках, в домашней и внеклассной работе учащихся.
Для установления межпредметных связей необходимо осуществить отбор материалов, то есть определить те темы химии, которые тесно переплетаются с темами из курсов других предметов.
Курсовое планирование предполагает краткий анализ содержания каждой учебной темы курса с учетом внутрипредметных и межпредметных связей.
1.1 Использование межпредметных связей для формирования у учащихся основ диалектико-материалистического мировоззрения
Использование опорных знаний других предметов при изучении отдельных тем курса химии – важнейшее средство формирования у учащихся диалектико-материалистического мировоззрения, целостного представления о явлениях природы и взаимосвязи между ними.
Решение этой задачи успешно осуществляется при совместной согласованной работе учителей различных дисциплин: природоведения, химии, физики, географии, биологии, математики, обществоведения, истории и др. Рассмотрим те межпредметные связи курса химии, которые касаются формирования основ научно-материалистического мировоззрения учащихся. Рассмотрим это на отдельных примерах.
Изучению курса химии в 8 классе предшествуют курсы природоведения и ботаники, в которых учащиеся получают первоначальные представления о живой и неживой природе. Эти знания мы считаем опорными при рассмотрении различных разделов темы: “Первоначальные химические понятия”. Так, в курсе природоведения учащиеся изучали вещества: кислород, углекислый газ, воду и смеси веществ, песок, глину, получили некоторые сведения об использовании угля, руды, нефти, способах разделения смесей. Для углубления и расширения этих знаний предлагаем восьмиклассникам вопросы:
1. Какие вещества, изученные вами в предыдущих классах, относятся к чистым веществам, а какие к смесям?
2. Почему не имеют смысла выражения “молекула воздуха”, “молекула гранита”, “молекула нефти”?
3. Как отделить речной песок от опилок?
4. Почему нельзя фильтрованием выделить из раствора поваренную соль?
Обсуждение этих вопросов позволяет приступить к формированию понятий “тело”, “вещество” (как один из основных видов материи). Предлагаем учащимся самостоятельно, используя знания из курса физики, природоведения, географии привести примеры тел и веществ, обращаем внимание на их разнообразие, сходство и различие по свойствам. Подчеркиваем, что свойства веществ проявляются в конкретных условиях при том или ином воздействии на вещество и при взаимодействии его с другими веществами. Отмечаем, что отдельные свойства веществ при изменении условий при физических условиях могут меняться, но качества вещества будут оставаться прежними. Подчеркиваем, что под качеством понимается природа вещества, его индивидуальность. Внешне качество вещества проявляется в его свойствах. Обращаем внимание на то, что всякое изменение, превращение (химическая реакция) есть особый вид движения материи – химической формы движения. Вещества, отличающиеся по составу молекул, по разному ведут себя при химических реакциях.
При изучении простых и сложных веществ предлагаем ученикам вспомнить, с какими из них они ранее познакомились в курсе природоведения, каких веществ в природе больше – простых или сложных. Обращаем их внимание на разнообразие простых и сложных веществ.
Сообщая учащимся, что химические элементы делятся на две группы: металлы и неметаллы, мы отличаем наличие в них противоположных свойств и в то же время отсутствие резких границ между ними. Так формируется понятие о взаимосвязях веществ.
При рассмотрении понятия о валентности как свойстве атомов химических элементов, повторяем постоянство состава веществ и формируем понятие “количество”. Разъясняем, что количественные данные характеризуют отношения масс между элементами в сложном веществе в соотношении с их валентностью, относительной атомной и молекулярной массой, числом атомов в молекуле (для веществ с молекулярным строением), а также физические величины: плотность, температура кипения, замерзания и т.д. Через количественные соотношения входящих в состав данного вещества элементов выражается постоянство состава чистых веществ.
При изучении первоначальных химических понятий представляется возможность развить полученные в курсе природоведения 5 класса знания о веществе, в курсе физики 7 класса – физических и химических явлениях. Подчеркиваем реальность (объективное существование) атомов и молекул, существование веществ независимо от нашего сознания, объективность свойств веществ.
Рассматривая закон сохранения массы веществ, знакомим учеников с количественной стороной химических процессов. В ходе этой работы обсуждаем вопросы:
1) Будет ли масса сульфида железа (II) равна массе железа и серы, вступивших в реакцию?
2) Каковы массы кислорода и водорода, полученные при разложении воды? Сравните массы веществ до и после реакции.
3) Как можно объяснить сохранение массы веществ в свете атомно-молекулярного учения?
4) Объясните, почему масса угля и золы, образовавшихся при горении дров, меньше массы сгоревших дров?
5) Какое значение имеет закон сохранения массы веществ для практического получения веществ?
После обсуждения этих вопросов делаем вывод о неуничтожимости и несотворимости веществ (вечности материи).
Обращаем внимание на характеристику количественной и качественной сторон химической реакции. Указываем, что общее для всех типов химических реакций (разложение, замещение, соединение) – превращение веществ: возникновение из исходных новых веществ с новыми качествами, что и означает химическое движение. При это подчеркивается, что масса веществ, которые вступили в химическую реакцию, всегда равна массе веществ, образовавшихся в результате реакции. Из закона сохранения массы веществ следует, что вещества не могут возникать из ничего или превращаться в ничто.
Изучая тему “Кислород. Оксиды. Горение.” даем определения понятий “свойство” и “качество”, используя при этом знания о свойствах кислорода, полученные в курсе природоведения.
После изучения темы “Вода. Растворы. Основания.” предлагаем учащимся выполнить самостоятельные практические работы. При этом используем вещества, которые изучались в курсе природоведения (“Воздух”, “Вода” и др.), в курсе ботаники (“Дыхание семян”, “Дыхание листьев”), а также в курсе физики. Даем задание осуществить превращения:
C ® CO2 ® H2CO3 ® Na2CO3
Практические работы такого характера раскрывают взаимосвязь между различными классами химических соединений, развивают идею о познаваемости мира.
Исходя из превращений, осуществляемых при переходе от одних веществ к другим, даем определение понятия “развитие” (переход от одного качественного состояния к другому).
Большое научное и мировоззренческое значение имеют темы: “Периодический закон и периодическая система химических элементов Д.И. Менделеева”, “Строение атома”. Показываем, что все химические элементы имеют общую материальную основу: “общность элементов проявляется и том, что все они являются членами упорядоченной совокупности периодической системы элементов”.
На следующих уроках развиваются знания о строении атомов, полученные в курсе физики 7 класса. При этом изучение проводится так, чтобы оно способствовало формированию диалектико-материалистического мировоззрения. В ходе урока ученики убеждаются во внутреннем противоречии в структуре атома (атом как единство и борьба противоположностей): в его состав входит положительно заряженное ядро и отрицательно заряженные электроны. Единство этих противоположностей есть условие существования атомов как электронейтральных частиц.
Автор учебника химия-8 (“Просвещение”, 1995г.) Леонид Степанович Гузей считает, что в настоящее время ПСХЭ следует рассматривать как справочное пособие к строению атома и периодического закона Д.И. Менделеева рассматривать соответственно этой концепции.
Не менее важно и то, что межпредметные связи позволяют более целесообразно планировать изучение материала, экономить время, при этом знания по другим предметам конкретизируются, углубляются, обобщаются.
1.2 Пути и методы реализации межпредметных связей
Вопрос о путях и методах реализации межпредметных связей – это один из аспектов общей проблемы совершенствования методов обучения. Отбор методов обучения учитель производит на основе содержания учебного материала и на подготовленности учащихся к изучению химии на уровне межпредметных связей.
На первых этапах обучения учащихся приемам установления межпредметных связей преобладает объяснительно-иллюстративный метод. Учитель весь материал межпредметного содержания объясняет сам. Когда у учащихся сформируются умения работы с материалом межпредметного содержания, можно применять репродуктивный и частично-поисковый методы и творческие межпредметные задачи.
Средства реализации межпредметных связей могут быть различны:
· вопросы межпредметного содержания: направляющие деятельность школьников на воспроизведение ранее изученных в других учебных курсах и темах знаний и их применение при усвоении нового материала.
· межпредметные задачи, которые требуют подключения знаний из различных предметов или составлены на материале одного предмета, но используемые с определенной познавательной целью в преподавании одного другого предмета. Они способствуют более глубокому и осмысленному усвоению программного материла, совершенствованию умений выявить причинно-следственные связи между явлениями.
· домашнее задание межпредметного характера – постановка вопросов на размышление, подготовка сообщений, рефератов, изготовление наглядных пособий, составление таблиц, схем, кроссвордов, требующих знаний межпредметного характера.
· межпредметные наглядные пособия – обобщающие таблицы, схемы, диаграммы, плакаты, диаграммы модели, кодопозитивы. Они позволяют учащимся наглядно увидеть совокупность знаний из разных предметов, раскрывающую вопросы межпредметного содержания.
· химический эксперимент – если предметом его являются биологические объекты и химические явления, происходящие в них.
Использование межпредметных связей вызвало появление новых форм организации учебного процесса: урок с межпредметными связями, комплексный семинар, комплексная экскурсия, межпредметная экскурсия и др.
Уроки с межпредметным содержанием могут быть следующих видов: урок-лекция; урок-семинар; урок-конференция; урок-ролевая игра; урок-консультация и др.
· уроки межпредметного обобщения или тематические задания – проблема педагогики и методики как соединить знания с практической полезной деятельностью. Научить применять знания.
Суть тематического планирования заключается в следующем: группам учащихся дается задание разработать рекомендации по использованию удобрений, веществ, реакций относительно данной местности. Эти задания имеют МПС и готовятся совместно с учителями биологии, географии, черчения, рисования – это бинарные уроки.
Ход проведения: группа из 4-6 человек выбирает руководителя проекта, специалистов (биолог, агроном, чертежников, художник-оформитель), определяет задания каждому ученику. Группы собираются и отчитываются о работе.
Каждой группе дается своеобразное домашнее задание, которое будет завершено защитой своих работ. Вначале такого урока – краткая беседа учителя, в ходе которой ставится цель, представляются учащиеся, определяется порядок защиты. Затем идут выступление групп – в виде краткого отчета о проделанной работе (демонстрация рисунков, таблиц). Далее идет обсуждение выступлений; учитель продумывает со своими коллегами трудовое задание. Обязательно прослеживается связь с окружающей средой.
По этим урокам можно сделать вывод:
1. Все уроки связаны педагогической логикой.
2. Строго выполняется учителем тема по программе.
3. Включено обязательно решение задач.
4. Главное достоинство – ученики учатся учиться по указанию учителя.
5. Но самое главное – все задания выполняются самостоятельно.
Конкретные примеры – в приложении 1 дипломной работы.
1.3 Межпредметные связи в процессе изучения химии в 9 классе
Отражение межпредметных связей и определение содержания в программах : а) для обычных классов без специализации – программа курса химии для 8-11 классов средней общеобразовательной школы – разработана в лаборатории химического образования Института общеобразовательной школы РАО – Москва “Просвещение” 1993 год, тема “Подгруппа углерода” – 7 часов. б) программа курса неорганической химии для 8-9 классов химико-биологического профиля (авторы: Н.Е. Кузнецова, Г.П. Никифорова, И.М. Титова, А.Ю. Жегин) на тему “Неметаллические соединения и их важнейшие химические соединения” отводится 50 часов, на тему “Углерод и его соединения” – 16 часов, является своевременным и важным положением в системе обучения учащихся, поскольку методически обоснованное осуществление межпредметных связей в процессе изучения школьных дисциплин способствует повышению качества знаний учащихся, развитию их мыслительной деятельности.
Реализация межпредметных связей при изучении химии является одной из форм логического повторения, углубления и совершенствования приобретенных знаний.
Поскольку межпредметные связи обеспечивают привлечение учащимися на уроках знаний из области других предметов, важно с учетом требований программ выделить наиболее общие, устойчивые и долговременно действующие межпредметные понятия. Примером таких понятий могут быть понятия о составе, строении, химических свойствах и биологических функциях веществ. При отборе и использовании межпредметной информации важно не нарушить логику построения учебных предметов и не допускать перегрузки их содержания.
Способы привлечения знаний из других предметов различны. Можно предложить учащимся при подготовке к занятиям восстановить в памяти ранее изученные вопросы. В отдельных случаях учитель при изложении нового материала сам напоминает сведения, полученные при изучении других предметов, включая при этом учащихся в активную беседу. Опыт учителей-методистов показывает, что установление взаимосвязей между предметами успешно проходит при включении в содержание урока (или в задание на дом) примеров и задач межпредметного характера.
Для того, чтобы успешно реализовать межпредметные связи в учебной деятельности, учитель химии должен прежде всего овладеть содержанием соответствующих дисциплин.
Конкретизация использования межпредметных связей в процессе обучения достигается с помощью поурочного планирования. Последнее осуществляется с учетом вида урока с межпредметными связями:
фрагментальный, когда лишь фрагменты, отдельный этап урока, требует реализации связей с другими предметами;
узловой, когда опора на знания из других предметов составляет необходимое условие усвоения всего нового материала или его обобщения в конце учебной темы;
синтезированный, который требует синтеза знаний из разных предметов на протяжении всего урока и специально проводится для обобщения материала ряда учебных тем или всего курса.
Поурочный план – разработка показывает, когда, на каком этапе урока и как, какими способами, включаются знания из других курсов в изучении нового или закрепления учебного материала. Особенно необходима тщательная разработка обобщающего урока с межпредметными связями. Выделение таких уроков производится на основе тематического планирования. Поурочное планирование может быть выполнено в виде плана конспекта или в виде таблицы
| этапы урока | вопросы МП содержания | методы и приемы | средства наглядности | внутрипредметные и межпредметные связи |
Составляя поурочные планы, учителю важно знать, что учащиеся уже усвоили из необходимых опорных знаний на уроках по другим предметам, согласовать с учителями смежных предметов постановку вопросов и заданий, чтобы избежать дублирования и достигнуть развития общих идей и понятий, их углубления и обогащения. Этому помогает взаимопосещение уроков и изучение составляемых коллегами планов реализации межпредметных связей.
Таким образом, планирование составляет необходимое и существенное условие подготовки учителя к эффективному осуществлению межпредметных связей и является одним из средств их реализации в практике обучения школьников.
Предлагаю тематическое планирование по теме “Подгруппа углерода” в курсе химии 9 класса в приложении 2.
1.4 О связи обучения химии и географии
Помимо межпредметных связей между химией, биологией, учителя используют и сведения из географии. В 8 классе во время объяснения состава воздуха и его применения можно использовать знания учащихся об атмосфере, полученные ими на уроках географии. Восьмиклассники могут дать правильные ответы на вопросы: какое значение имеет атмосфера для живых организмов? Назовите атмосферные слои, расскажите о составе воздуха. Затем учитель сам дополняет рассказ о составе воздуха и его применении.
Проблема парникового эффекта
При изучении свойств воды задаем учащимся следующие вопросы:
1. На какие группы подразделяются материковые воды? Отмечаем, что образование горячих источников связано с остыванием вулканов, в процессе которого из их сопел начинают бить гейзеры. Подчеркиваем, что возникновение гейзеров не связано с какими-то божественными силами. Учащиеся узнают о значении воды в жизни человека, ее химическом составе и получении чистой воды.
2. Расскажите об очистке природной воды.
3. Какое значение имеет очистка питьевой воды?
4. Где используют воду?
В 9 классе при изучении минеральных удобрений используем знания учащихся по экономической географии. Ученики рассказывают о значении минеральных удобрений для повышения урожайности сельскохозяйственных культур, о роли химии в развитии животноводства. После этого дополняем более подробными сведениями материал о свойствах минеральных удобрений и их разновидностях. Выделяется удобрение мочевина CO(NH2)2 и его роль в питании животных.
Во время изучения основных видов горючего 10 класс 5 тема “Природные углеводороды” предлагаем учащимся следующие вопросы:
1. Назовите крупнейшие месторождения каменного угля.
2. Расскажите о месторождениях нефти.
3. Где находятся крупные месторождения природного газа?
Ученики показывают на географической карте где находятся эти месторождения.
При знакомстве в 10 классе с каучуком учащиеся вспоминают страны – основные производители натурального каучука: Бразилию, Индонезию.
В декаду естественных наук можно организовать турнир знатоков, в который можно включить вопросы по химии и географии – в приложении 4.
1.5 Межпредметные связи неорганической, органической химий и физики.
“Химик без знания физики подобен
человеку, который всего должен искать
ощупом. И сии две науки так соединены
между собой, что одна без другой в
совершенстве быть не могут”
М.В. Ломоносов.
Эти слова подтверждаются делом учителями-методистами, когда первые химические понятия строятся на тех знаниях учеников, которые они получают на уроках физики.
8 класс. При изучении темы “Первоначальные химические понятия” можно использовать знания учащихся важных понятий, сформированных в курсе физики 7 класса. К ним относятся: тело, вещество, атом, молекула, физические и химические явления, внутренняя энергия, температура. Из курса физики учащимся известны также общие сведения о строении твердых тел, жидкостей и газов, положения молекулярно кинетической теории.
Необходимо учитывать, что большинство физических понятий находятся в процессе формирования, а поэтому на данном этапе обучения учащихся эти понятия сформированы еще недостаточно строго. Это относится и к таким изначальным понятиям, как тело и вещество. Под физическим телом учащиеся понимают каждое из окружающих тел, а под веществом – один из видов материи.
Достаточно полное представление получили учащиеся в 7 классе на уроках физики о молекулах. Они узнали, что молекулы – мельчайшие частицы вещества, кроме того им известно, что молекулы одного вещества одинаковы, что они находятся в непрерывном движении. На уроках химии это понятие углубляется, расширяется.
На уроках физики учащиеся знакомятся с понятием массы вещества, которое вводится в процессе анализа опыта по взаимодействию тележек. Этот опыт исключает в дальнейшем путаницу в понятиях вес тел, их масса.
В 7 классе начинается формирование первых представлений об энергии. Учащиеся узнают, что энергию, определяемую взаимным расположением тел, называют потенциальной, а энергию движущихся тел – кинетической. Каждое тело, состоящее из большого числа частиц (атомов и молекул) обладает внутренней энергией, характеризующейся суммой кинетической и потенциальной энергий всех частиц.
Углубленное изучение энергетики химических реакций осуществляется по учебнику Ахметова “Химия, 8-9”.
Энергетика химических реакций.
Знание закономерностей химических реакций позволяет прогнозировать их протекание. Можно получать вещества с требуемыми свойствами.
Для изучения данной темы необходимо повторить с учащимися материал из курса физики, касающийся закона сохранения и превращения энергии.
При химическом превращении, т.е. в период протекания химической реакции происходит перестройка электронных структур атомов, ионов, молекул. Поэтому химическая реакция всегда сопровождается энергетическими изменениями.
Тепловые эффекты реакций можно определить и экспериментально, и с помощью термохимических расчетов.
В основе данных расчетов лежит закон, сформулированный Г.И. Гессом. Даем формулировку данного закона и приводим пример, давая пояснения: “Тепловой эффект реакции зависит от вида и состояния исходных веществ и конечных продуктов и не зависит от пути процесса”. В качестве примера возьмем реакцию полного сгорания угля:
C(k) + O2(r) ® CO2(r); DH1 = -393,5 кДж
Предлагаем учащимся допустить, что данный химический процесс протекает в две стадии.
I стадия – при горении угля образуется оксид углерода (II) CO:
C(k) + 1/2 O2(r) ® CO(r); DH2 = -110,5 кДж
II стадия – при сгорании CO образуется оксид углерода (IV) CO2:
CO2(r) + 1/2 O2(r) ® CO2(r); DH3 = -283,0 кДж
Суммируем эти две стадии:
C(k) + 1/2 O2(r) ® CO(r); DH2 = -110,5 кДж
CO2(r) + 1/2 O2(r) ® CO2(r); DH3 = -283,0 кДж
ѕѕѕѕѕѕѕѕѕѕѕѕѕѕѕѕѕѕѕѕ
C(k) + O2(r) ® CO2(r)
DH2 + DH3 ® -110,5 кДж + (-283,0 кДж) = -393,5 кДж
Исходя из закона Гесса тепловые эффекты образования CO2 и из простых веществ и через промежуточную стадию образования и сгорания CO равны:
DH1 = DH2 + DH3 = -393,5 кДж
Если бы тепловые эффекты не были бы равны, то нарушался бы закон сохранения энергии. В качестве подтверждения наших рассуждений приводим диаграмму на рис. 4.
![]()
![]()
![]() E
E
![]()
![]()
![]()
![]()
![]()
![]()
![]() C(k)
+ O2(r)
C(k)
+ O2(r)
DH2 = -110,5 кДж
![]()
![]()
![]()
![]()
![]()
![]()
![]() CO(r)
+ 1/2 O2(r)
CO(r)
+ 1/2 O2(r)
![]() DH1
= -393,5 кДж DH3
= -283,0 кДж
DH1
= -393,5 кДж DH3
= -283,0 кДж
![]()
![]()
![]()
![]()
![]() CO2(r)
CO2(r)
Из диаграммы видны различия в энергии исходных, промежуточных и конечных продуктов. На диаграмме они отвечают тепловым эффектам соответствующих реакций. Делаем вывод, что DH1 = DH2 + DH3.
При изучении темы “Кислород. Оксиды. Горение.” можно использовать понятие плотности веществ, с которыми учащиеся познакомились в 7 классе на уроках физики, а также количество теплоты и теплоты сгорания топлива, изученные уже в 8 классе.
Под плотностью вещества r учащиеся понимают величину, равную соотношению массы тела к его объему
r = m/V, где m – масса вещества, V – объем тела.
По международной системе единиц, масса измеряется в килограммах, а объем – в кубических метрах. Следовательно, плотность имеет обозначение кг/м3.
Изучая тему “Водород. Кислоты. Соли.” можно использовать знания учащихся о подъемной силе газов. Подъемной силой газов (разумеется легче воздуха) называется разность между весом воздуха, объемом 1м3 и весом газа того же объема. Например, воздух объемом 1м3 весит 13H, а вес водорода, объемом 1м3 составляет 0,3H (при н.у.), 1H = 1кг·10м/с2. Следовательно, подъемная сила водорода будет равна 12,1H. Обладая такой подъемной силой, водород объемом 1м3 способен поднять тело массой равной:
12,1 кг·м/с2 : 10 м/с = 1,21 кг.
Межпредметные связи химии и физики могут быть реализованы не только в процессе формирования теоретических, химических понятий, но и при проведении практических работ. Так, при изучении темы “Вода. Основания. Растворы.” учащиеся выполняют практическую работу по приготовлению раствора соли с заданной массовой долей. Для проведения данной работы необходимо взвесить соль. С правилами же взвешивания на рычажных весах учащиеся познакомились на уроках физики в 7 кл.
В качестве примера: 8 кл. “Практическая работа № 4” – приложение 6.
При изучении темы “Периодический закон и периодическая система химических элементов Д.И. Менделеева” можно опереться на знания учащихся о строении атомов, полученные ими на уроках физики в начале 8 класса. На основе изучения схемы опыта Резерфорда учащиеся узнали, что атомы состоят из ядер и вращающихся вокруг них электронов, что ядро массивно и заряжено положительно. По величине этот положительный заряд равен суммарному отрицательному заряду всех электронов, движущихся вокруг ядра. Поэтому атом в целом электронейтрален. На практике мне удалось опробовать данную тему. Надо отметить, что тема сложна, т.к. требует большого пространственного воображения. Для того, чтобы у детей осталось в памяти строение атома, предлагала им следующую схему:
![]()
![]() Атом0
Атом0
ядра я+ электронов e-
![]()
![]() m = 1
m нет
m = 1
m нет
протонов p+ нейтронов n0
В процессе дальнейшего развития представлений о строении атома учащиеся узнают, что основной его характеристикой является заряд ядра, что ядро состоит из протонов и нейтронов и число электронов в атоме равно числу протонов. Все эти знания можно использовать при объяснении физической сущности основных характеристик периодического закона Д.И. Менделеева.
При изучении темы “Химическая связь” могут быть использованы знания учащихся об ионах и их зарядах, о взаимодействии заряженных частиц (тел), электрическом поле.
В курсе физики 7 кл. – начала 8 кл. учащиеся узнают о том, что в результате отрыва электронов от атомов или, наоборот, присоединения электронов к атому образуются ионы. Физики ионом называют заряженный атом, у которого число электронов не соответствует числу протонов. Поэтому на уроках химии учащиеся первое время могут называть ионы заряженными атомами.
При изучении темы “Основные закономерности протекания химических реакций” можно использовать знания учащихся о скорости и равновесии, полученные ими в курсе физики 7 и 8 классов. Под скоростью (средней и мгновенной) учащиеся понимают отношение величины перемещения тела к промежутку времени, в течение которого произошло это перемещение
vср = s/t; vмг = DS/Dt,
где vср – средняя скорость, vмг – мгновенная скорость. Знак D означает небольшое изменение.
Реализация межпредметных связей химии и физики в 8 классе при изучении видов химических связей может быть произведена с целью углубления химических понятий, их формулировки. Рассмотрим возможный пример взаимосвязи двух дисциплин при изучении ионной связи.
Урок начинаем с повторения известного учащимся материала по следующим вопросам: Что называется ионами? По каким свойствам отличаются ионы от атомов? На какие две группы можно разделить ионы по знаку их зарядов?
Затем переходим к объяснению химических явлений, приводящих к появлению ионов.
10 класс. Немного о межпредметных связях органической химии и физики.
В теме, посвященной изучению непредельных углеводородов, общая формула которых CnH2n-2, используются такие физические понятия, как “остаточная деформация твердых тел”, “упругость”, “пластичность”. На уроках физики учащиеся знакомились с явлением деформации тел, с процессами, вызывающими деформацию, с силой упругости, возникающей при деформации тела. Они также узнают о том, что способность тел к деформации зависит от природы вещества, из которого состоит это тело, от условий, в которых оно находится, и от способов его изготовления.
Знания этого материала помогут школьникам разобраться в некоторых физических особенностях полимерных материалов. Например, со свойством эластичности полимерных материалов они встречаются впервые и не всегда правильно связывают с другими видами деформации. Поэтому в данном случае необходимо применить сравнение. Вначале демонстрируют кручение пластинок из каучука, резины, стальной линейки, медной пластинки. Учитель предлагает ученикам объяснить, почему под действием одинаковой внешней силы происходит неодинаковое изменение формы, почему не все пластинки после прекращения действия внешней силы приобретают первоначальные размеры. Данные вопросы могут вызвать затруднения и поэтому лучше, если учитель сам разъяснит их.
При изучении сложных эфиров и жиров можно использовать знания учащихся о поверхностном натяжении и веществах, его изменяющих.
Рассмотрим, на какие основные вопросы курса физики необходимо сослаться при изучении жиров. Во-первых, учащиеся должны знать, что поверхностное натяжение есть сокращение поверхности жидкости за счет притягивания поверхностных молекул другими молекулами, расположенными в нижних слоях жидкости. Во-вторых, в результате действия молекулярных сил притяжения и отталкивания плотность жидкости в поверхностном слое меньше, чем внутри, т.е. межмолекулярное расстояние между молекулами, лежащими в глубине. В-третьих, учащиеся знакомы с величинами, характеризующими поверхностное натяжение: поверхностная энергия, коэффициент поверхностного натяжения, зависимость коэффициента поверхностного натяжения от природы жидкости и от температуры.
Не ограничиваясь рассмотренными выше примерами, каждый учитель сам может установить, знания каких курсов, вопросов курса физики можно использовать на уроках.
Использование учителями в учебной практике межпредметной связи способствует более углубленному усвоению учащимися учебного материала всего курса химии.
1.6 Межпредметные связи при проблемном обучении химии
Проблемное обучение химии всегда связано с интенсивным мыслительным процессом, с широким использованием в ходе решения учебной проблемы аргументации рассуждений и доказательности истинности суждений. Важное место здесь занимают межпредметные связи с курсом математики и физики. Они помогают или утвердить правильность выдвинутых гипотез, или опровергнуть их.
Рассмотрим, как при изучении темы 8 класса “Количественные отношения в химии” решается следующая учебная программа в виде проблемы: “Истинно ли утверждение, что массовые отношения газов, находящихся в емкости, относятся 7:1, если емкость, содержащая 6,72 м3 газовой смеси, заполнена на 1/3 азотом и 2/3 водородом (по объему, н.у.)?”
Указанная проблема может быть решена лишь на основе установления взаимосвязи химии, математики и физики. Поэтому познавательная задача, которая возникает на уроке, должна включать использование знаний всех этих трех дисциплин.
Элементы математики используются для усиления содержательных положений, которые дают химия и физика.
На уроке проводятся следующие математические доказательства:
1. Масса азота объемом в 1 м3 равна 1,25 кг. Если M = 28·10-3 кг/моль, а Vm = 22,4·10-3 м3/моль, то по формуле r = M/Vm находим r = 1,25 кг/м3. Масса азота объемом в 1 м3 определяется по уравнению m = r·V. Числовые значения r и m в данном случае совпадают m = 1,25 кг.
2. Масса водорода объемом в 1м3 равна 0,089 кг. Если M = 2·10-3 кг/моль, а Vm = 22,4·10-3 кг/моль, то по формуле
r = M/Vm = 0,089 кг/м3
Масса водорода объемом в 1 м3 определяется по уравнению m = r·V. Числовые значения r и V совпадают.
m = 0,089 кг (1м3·0,089 кг/м3)
3. Объем азота равен 2,24 м3 (1/3·6,72 м3)
4. Объем водорода равен 4,48 м3 (2/3·6,72 м3)
По формуле m = r·V находим массы азота и водорода.
Масса азота равна 2,8 кг (1,25 кг/м3·2,24 м3).
Масса водорода равна 0,4 кг (0,089 кг/м3·2,24 м3).
При объемных отношениях азота и водорода 1/3 : 2/3 отношение масс будет 2,8 (кг) : 0,4 (кг), следовательно, утверждение, что массовые отношения газов в заданной емкости 7 : 1 истинно.
Другое время, когда в практике обучения химии возникает необходимость в опровержении неправильных гипотез учащихся.
В 8 классе в теме “Галогены” учащиеся, изучая химические свойства хлора, узнают о том, что это вещество может взаимодействовать с водородом с образованием хлорводорода. Обычно на вопрос, как получить хлорводород в лаборатории, большинство учащихся высказывают неправильное предположение о том, что в лаборатории хлорводород можно получить при взаимодействии хлора и водорода в эвдиометре. И тогда, с целью предупреждения таких неправильных суждений учащихся, ставим вопрос: можно ли использовать эвдиометр для лабораторного получения хлорводорода? Убедительный ответ на него противоречит правильному. Это создает проблемную ситуацию. Возникает проблемный вопрос: какой объем водорода и хлора необходим для получения хлорводорода объемом в 1 л? В ходе беседы ученики отмечают, что согласно уравнению реакции H2 + Cl2 ® 2 HCl для получения хлорводорода объемом в 1 л требуется хлора объемом 0,5 л и водорода объемом 0,5 л, т.е. общий объем смеси равен 1 л. Учитель говорит, что по условиям техники безопасности объем взрываемой смеси не должен превышать 1/10 части эвдиометра, потому объем всего эвдиометра должен быть в 10 раз больше, т.е. составлять 10 л. Если предположить, что диаметр такого эвдиометра 2 см, то его высоту можно рассчитать, используя знания по математике о вычислении объема цилиндра:
V = (p·D2/4) ·h; отсюда h = (4·V/p·D2)
Подставив числовые значения, получаем h » 3184 см. Приведенными расчетами завершаем решение проблемы. Учащиеся убеждаются в неверности своих суждений. Сейчас любые опыты с эвдиометром запрещены и эти расчеты показывают о непреемственности данного способа для получения хлорводорода в лабораторных условиях.
Осуществление связи обучения химии и физики можно показать при изучении вопроса о строении твердых веществ. Учебную проблему здесь формулируем так: от чего зависят свойства кристаллических тел? Поиск решения данной проблемы идет путем установления связей с курсом физики 7-8 классов, используя знания, полученные на уроках физики, учащиеся в ходе обсуждения этого проблемного вопроса говорят, что вероятно, свойства кристаллических тел зависят от частиц, из которых построен кристалл.
На уроке этот вопрос мы решаем путем привлечения и постановки ряда физических опытов. В два стаканчика помещаем одинаковое количество “сухого льда” (оксид углерода IV) и чистого кварцевого песка (оксид кремния IV). Стаканчики устанавливаем на разные чашки весов. Через некоторое время масса кристаллического оксида углерода (IV) начинает уменьшаться. Это изменение фиксируем как визуально, так и показаниями весов. Масса оксида кремния (IV) остается без изменения. С помощью горящей лучинки устанавливаем, что в стакане с “сухим льдом” находится газообразный оксид углерода (IV). На основе опыта определяем, что оксид углерода (IV) легко возгоняется, а оксид кремния (IV) не возгоняется обычной температуре. Поясняем, что углекислый газ имеет молекулярную кристаллическую решетку. Молекулы слабо связаны друг с другом, поэтому вещество легко возгоняется. SiO2 тугоплавок, т.к. в узлах кристаллической решетки содержатся атомы Si и O, которые связаны прочными ковалентными связями. Подтверждается главная идея химии.
Затем ставим второй опыт. Берем кусок магния с ярко выраженным кристаллическим строением на изломе и кристаллический хлорид натрия в стаканчике. С помощью прибора устанавливаем электрическую проводимость магния и отсутствие ее у хлорида натрия. Хлорид натрия растворим в воде и раствор испытываем на электрическую проводимость. Ставим вопрос: как объяснить это свойство вещества? Проблему решаем с помощью тех знаний, которые учащиеся получили в курсе физики 8 кл. Учащиеся дают примерно такой ответ. В узлах кристаллической решетки металла расположены ионы, обладающие положительным зарядом, нейтральные атомы, а также отрицательно заряженные электроны. Отрицательный заряд всех свободных электронов по абсолютной величине равен положительному заряду всех ионов решетки. Поэтому в обычных условиях металл электрически нейтрален. Беспорядочное движение электронов не создает тока в металле, но если в металле создать электрическое поле, то все свободные электроны начнут двигаться в направлении действия электрических сил, возникает электрический ток, представляющий поток электронов.
Хлорид натрия в твердом состоянии не обладает электрической проводимостью, и это говорит о том, что в нем свободных электронов нет. Значит, причина электрической проводимости хлорида натрия в растворе другая. Из курса физики известно, что “при растворении солей в воде их кристаллы распадаются на положительные и отрицательные ионы. Электрический ток в растворе представляет собой направленное движение положительных и отрицательных ионов”. Различия в свойствах двух веществ объясняются различием кристаллических решеток. У хлорида натрия ионная кристаллическая решетка, у магния – металлическая. В подтверждение этого демонстрируем таблицу.
| вещество | тип кристаллической решетки | температура плавления | отношение к воде |
| оксид углерода IV | молекулярная |
-57°C при 0,5 МПа |
малорастворимая |
| оксид кремния | атомная |
1705°С |
нерастворимая |
| хлорид натрия | ионная |
1465°C |
растворимая |
| магний | металлическая |
650°C |
нерастворимая |
Делаем вывод: свойства кристаллических тел зависят от частиц, которые находятся в узлах кристаллических решеток. По этому признаку все кристаллические решетки делятся на молекулярные, атомные, ионные и металлические.
Таким образом, использование межпредметных связей является одним из важнейших способов совершенствования учебно-воспитательного процесса. Рассмотрение отдельных разделов химии во взаимосвязи с физикой, математикой обеспечивает лучшее понимание вопросов, помогает творчески мыслить. Все это позволяет использовать проблемный подход в обучении, который считается более эффективным.
1.7 Межпредметные связи при решении расчетных задач
К изучению математики учащиеся средней школы приступают на 7 лет раньше, чем к изучению химии. За этот период обучения они приобретают значительный объем математических знаний, умений и навыков по решению алгебраических задач. Правильное использование учителем химии приобретенного учащимися объема знаний, умений и навыков является той основой, которая в наибольшей мере способствует успешному обучению их решению расчетных химических задач.
При составлении плана решения данная сложная задача расчленяется на ряд простых, связанных между собой общим содержанием задачи. Составляя план решения задачи, используют два основных метода:
а) синтетический;
б) аналитический.
Суть каждого из этих методов рассмотрим на примере составления плана решения конкретной задачи.
Задача. Почетный горняк Митрофанов за 30 лет работы бурильщиком в рудниках Криворожского железнорудного бассейна добыл 1 млн. т железной руды, содержащей в среднем 80% оксида железа (III). Сколько велосипедов можно изготовить из этой руды, если принять, что на изготовление одного велосипеда расходуется 20 кг железа?
Синтетический метод
1. Зная массовую долю (в %) оксида железа (III) в железной руде, находим его массу, содержащуюся в 1 млн. т руды.
2. Узнав массу оксида железа (III), вычислим массу содержащегося в нем железа.
3. Узнав массу железа в добытой руде и зная массу железа, переработанного в сталь и нужную на изготовление одного велосипеда, определим число велосипедов.
Исходя из этих соображений, составляют такой план решения задачи:
1. Сколько тонн оксида железа (III) составляют 80% от 1 млн. т железной руды?
2. Сколько тонн железа содержится в вычисленной массе оксида железа (III)?
3. Сколько велосипедов можно изготовить из вычисленной массы железа?
Аналитический метод
Исходят из вопроса задачи. Чтобы узнать число велосипедов, необходимо знать массу железа, а чтобы вычислить массу железа, нужно знать массу оксида железа (III), в котором оно содержится.
Синтетический метод составления плана решения задачи имеет свои недостатки. Главный недостаток заключается в том, что первые шаги при решении задачи (выбор данных для простой задачи) не всегда сразу приводят к искомому результату. Многие учащиеся, не имея навыков сравнивать и выбирать данные для простых задач, допускают ошибки двух видов:
а) в сравнении и выборе данных;
б) в составлении плана решения.
При составлении плана решения задачи аналитическим методом рассуждения строятся в противоположном направлении – от искомого числа к данным в условии задачи. В отличие от синтетического, аналитический метод составления плана решения задачи представляет собой ряд связанных между собой и вытекающих один из другого выводов и поэтому при его использовании учащиеся допускают меньше ошибок логического характера.
При изучении математики учащиеся усваивают оба метода составления плана решения задачи и поэтому учитель химии может пользоваться любым из них. Аналитический метод составления плана целесообразно использовать при решении сложных задач, условия которых содержат большое число данных, а синтетический – при решении сравнительно легких задач. При решении усложненных, например олимпиадных, задач часто приходится пользоваться обоими методами составления плана решения задач.
На уроках математики учащиеся приучаются к тому, что задачу можно считать решенной тогда и только тогда, когда найденное решение:
а) безошибочное (правильное);
б) мотивированное;
в) имеет исчерпывающий характер (полное).
Задача не считается решенной, если ее решение не соответствует хотя бы одному из этих требований.
Безошибочность (правильность) решения химических задач учащиеся обычно проверяют по ответам, которые приведены в сборниках задач и упражнений. Во многих случаях с целью проверки на уроках математики составляют и решают задачу, обратную решенной.
Проверку решения не обязательно выполнять для всех решаемых задач. Важно, чтобы учащиеся это умение использовали при решении химических задач и в необходимых случаях пользовались им. Слабоуспевающим учащимся можно предложить дома выполнить проверку решенных в классе задач. Это поможет им в усвоении методики решения задач и послужит закреплению того теоретического материала, на основе которого составлено условие задачи.
Исчерпывающий характер может иметь только то решение, которым найдены все неизвестные, содержащиеся в условии задачи. Если из ряда неизвестных, которые содержатся в условии задачи, не найдено хотя бы одно, такое решение нельзя считать полным.
Особое значение при решении химических задач имеет требование о мотивировке решения, выполнение которого должно содействовать закреплению изученного на ряде уроков, а иногда и в разных классах теоретического материала.
Несомненно, что использование умений и навыков, приобретенных учащимися при решении задач на уроках математики, повысит эффективность обучения учащихся решению химических задач.
МИНИСТЕРСТВО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
ПОМОРСКИЙ МЕЖДУНАРОДНЫЙ ПЕДАГОГИЧЕСКИЙ УНИВЕРСИТЕТ
ИМ. М.В. Ломоносова
факультет ЕСТЕСТВЕННО-МАТЕМАТИЧЕСКИЙ
кафедра ХИМИКО-ГЕОГРАФИЧЕСКИХ ДИСЦИПЛИН
допускаю к защите
зав. кафедрой _________________
подпись
Д И П Л О М Н А Я Р А Б О Т А
НА ТЕМУ: Межпредметные связи в курсе школьного предмета
химии на примере углерода и его соединений
РАЗРАБОТАЛ Борисова М.В.
РУКОВОДИТЕЛЬ Боголюбова З.К.
КОНСУЛЬТАНТЫ:
по ХИМИИ Воронцова Т.С.
по ГЕОГРАФИИ Ефремов И.В.
по ПЕДАГОГИКЕ Жукова М.В.
по МПХ
КОРЯЖМА
1996 год