:
Алканы - это предельные углеводороды, в молекулах которых все атомы связаны одинарными связями. Формула - 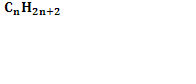
Физические свойства:
Температуры плавления и кипения увеличиваются с молекулярной массой и длиной главной углеродной цепи
При нормальных условиях неразветвлённые алканы с CH4 до C4H10 — газы; с C5H12 до C13H28 — жидкости; после C14H30 — твёрдые тела.
Температуры плавления и кипения понижаются от менее разветвленных к более разветвленным. Так, например, при 20 °C н-пентан — жидкость, а неопентан — газ.
Химические свойства:
Галогенирование
это одна из реакций замещения. В первую очередь галогенируется наименее гидрированый атом углерода (третичный атом, затем вторичный, первичные атому галогенируются в последнюю очередь). Галогенирование алканов проходит поэтапно — за один этап замещается не более одного атома водорода:
CH4 + Cl2 → CH3Cl + HCl (хлорметан)
CH3Cl + Cl2 → CH2Cl2 + HCl (дихлорметан)
CH2Cl2 + Cl2 → CHCl3 + HCl (трихлорметан)
CHCl3 + Cl2 → CCl4 + HCl (тетрахлорметан).
Под действием света молекула хлора распадается на радикалы, затем они атакуют молекулы алкана, забирая у них атом водорода, в результате этого образуются метильные радикалы ·СН3, которые сталкиваются с молекулами хлора, разрушая их и образуя новые радикалы.
Горение Основным химическим свойством предельных углеводородов, определяющих их использование в качестве топлива, является реакция горения. Пример:
CH4 + 2O2 → CO2 + 2H2O + Q
В случае нехватки кислорода вместо углекислого газа получается угарный газ или уголь (в зависимости от концентрации кислорода).
В общем виде реакцию горения алканов можно записать следующим образом:
СnН2n+2 +(1,5n+0,5)O2= nCO2 + (n+1)H2O
Разложение Реакции разложения происходят лишь под влиянием больших температур. Повышение температуры приводит к разрыву углеродной связи и образованию свободных радикалов.
Примеры:
CH4 → C + 2H2 (t > 1000 °C)
C2H6 → 2C + 3H2
Алкены:
Алкены-это непредельные углеводороды,содержащие в молекуле,кроме одинарных связей,одну двойную углерод-углеродную связь.Формула- CnH2n
Принадлежность углеводорода к классу алкенов отражают родовым суффиксом –ен в его названии.
Физические свойства:
Температуры плавления и кипения алкенов (упрощенно) увеличиваются с молекулярной массой и длиной главной углеродной цепи.
При нормальных условиях алкены с C2H4 до C4H8 — газы; с C5H10 до C17H34 — жидкости, после C18H36 — твёрдые тела. Алкены не растворяются в воде, но хорошо растворяются в органических растворителях.
Химические свойства:
Дегидратация-это процесс отщепления молекулы воды от молекулы органического соединения.
Полимеризация-это химический процесс соединения множества исходных молекул низкомолекулярного вещества в крупные молекулы полимера.
Полимер-это высокомолекулярное соединение ,молекулы которого состоят из множества одинаковых структурных звеньев.
Алкадиены:
Алкадиены -это непредельные углеводороды, содержащие в молекуле,кроме одинрных связей ,дведвойные углерод-углеродные связи.Формула-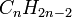 . Диены являются структурными изомерами алкинов.
. Диены являются структурными изомерами алкинов.
Физические свойства:
Бутадие́н — газ (tкип −4,5 °C), изопрен — жидкость, кипящая при 34 °C, диметилбутадиен — жидкость, кипящая при 70 °C. Изопрен и другие диеновые углеводороды способны полимеризоваться в каучук. Натуральный каучук в очищенном состоянии является полимером с общей формулой (С5Н8)n и получается из млечного сока некоторых тропических растений.
Каучук хорошо растворим в бензоле, бензине, сероуглероде. При низкой температуре становится ломким, при нагревании липким. Для улучшения механических и химических свойств каучука его превращают в резину, подвергая вулканизации. Для получения резиновых изделий сначала их формуют из смеси каучука с серой, а также с наполнителями: сажей, мелом, глиной и некоторыми органическими соединениями, служащими для ускорения вулканизации. Затем изделия нагревают — горячая вулканизация. При вулканизации сера химически связывается с каучуком. Кроме того, в вулканизированном каучуке сера содержится в свободном состоянии в виде мельчайших частиц.
Диеновые углеводороды легко полимеризуются. Реакция полимеризации диеновых углеводородов лежит в основе синтеза каучука. Вступают в реакции присоединения (гидрирование, галогенирование, гидрогалогенирование):
H2C=CH-CH=CH2 + H2 -> H3C-CH=CH-CH3
Алкины:
Алкины-этонепредельные углеводороды молекулы которых содержат ,помимо одинарных связей,одну тройную углерод-глеродную связь.Формула-CnH2n-2
Физические свойства:
Алкины по своим физическим свойствам напоминают соответствующие алкены. Низшие (до С4) — газы без цвета и запаха, имеющие более высокие температуры кипения, чем аналоги в алкенах.
Алкины плохо растворимы в воде, лучше — в органических растворителях.
Химические свойства:
Реакции галогенирования
Алкины способны присоединять одну или две молекулы галогена с образованием соответствующих галогенпроизводных:
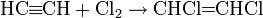
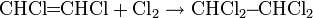
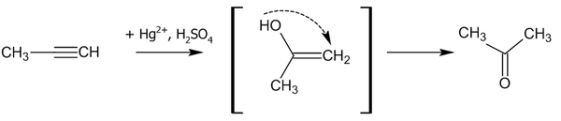
Гидратация
В присутствии солей ртути алкины присоединяют воду с образованием ацетальдегида (для ацетилена) или кетона (для прочих алкинов)
Другие работы по теме:
Предельные углеводороды
Алканы - предельные углеводороды, содержащие только простые связи углерода. Получение алканов: промышленный метод, нитрование и окисление. Углеводороды, содержащие двойную связь углерода - алкены или этиленовые углеводороды. Диеновые углеводороды.
ИК-спектральное проявление водородных связей
Сущность и природа водородной связи. Водородные связи и свойства органических соединений. Метод инфракрасной спектроскопии. Инфракрасное излучение и колебания молекул. Анализ спектральных характеристик растворов пространственно-затрудненных фенолов.
Органические соединения
Реферат 0.doc по химии Оглавление. Предельные углеводороды. (Алканы.). Нонан. 2 Непредельные углеводороды (Алкены. Алкины). Нонен-1. 4 Нонин-1 6 Спирты. Нониловый спирт. Нонанол-1. 8
Углеводороды таблица
Предельные углеводороды . Непредельные углеводороды . Ароматические или Арены Алканы Циклоалканы Алкены Диеновые Алкины 1.Общая формула CnH2n CH4-МЕТАН С6Н12-ГКСАН С10Н22-ДЕКАН
Предельные углеводороды алканы
«Уфимский Государственный Нефтяной Технический Университет» Кафедра: «Физическая и органическая химия» Реферат редельные углеводороды (алканы)
Типы химических реакций
Этиловый эфир ортрумуравьиной кислоты. Атомный состав молекулы (изомеризация). Крахмал и целлюлоза, их свойства. Изомеризация н-пентана в изопентан. Исходное вещество и продукт реакции изомеризации. Муравьиная кислота как сильный восстановитель.
Циклопарафины. Состав, строение, изомерия
Циклоалканы как ненасыщенные углеводороды, в молекулах которых имеется замкнутое кольцо из углеродных атомов, анализ их основных физических и химических свойств, общая формула и реакционная способность. Цис-транс-изомерия в циклических соединениях.
Циклоалканы – органические соединения
История открытия циклоалканов, их номенклатура, строение, изомерия, свойства, значение в жизни человека, а также общая характеристика методики их получения. Особенности межклассовой изомерии алкенов. Принципы дегалогенирования дигалогенопроизводных.
Алифатические предельные углеводороды и их строение
Особенности строения предельных углеводородов. Номенклатура углеводородов ряда метана. Химические свойства предельных углеводородов, их применение. Структурные формулы циклопарафинов (циклоалканов), их изображение в виде правильных многоугольников.
Метан
Атом углерода в молекуле метана находится в состоянии гибридизации.В результате перекрывания четырёх гибридных орбиталей атома углерода с орбиталями
Углеводороды
Предельные у-в. Непредельные у-в. Ароматические Алканы Циклоалканы Алкены Алкодиены Алкины Арены Общая формула CnH2n CnH2n CnH2n CnH2n-2 CnH2n-3 CnH2n-6
Углеводороды (таблица)
Предельные углеводороды . Непредельные углеводороды . Ароматические или Арены Алканы Циклоалканы Алкены Диеновые Алкины 1.Общая формула CnH2n -МЕТАН
Химия
Вопросы Гомологические ряды Алканы Алкены Алкины Общее понятие Общая формула 2n+2 2n-2 Тип гибридизации Число сигма связей 4.Наличие других видов связи
Таблица по разделу Органическая химия
Предельные углеводороды . Непредельные углеводороды . Ароматические или Арены Алканы Циклоалканы Алкены Диеновые Алкины 1.Общая формула CnH2n -МЕТАН
Органические соединения
Реферат 61314.0.1287405047.doc по химии Оглавление. Предельные углеводороды. (Алканы.). Нонан. 2 Непредельные углеводороды (Алкены. Алкины). Нонен-1. 4
Нефть
Реферат на тему “Нефть”. Нефть -масляная горючая жидкость обычно темного цвета со своеобразным запахом она немного легче воды и в ней не растворяется.
Алканы 2
Алканы 1. Методы получения. 2. Химические свойства. Алканы – это ациклические углеводороды, содержащие только простые связи С-С. Общая формула – СnH2n+2.
Углеводороды
Предельные у-в. Непредельные у-в. Ароматические Алканы Циклоалканы Алкены Алкодиены Алкины Арены Общая формула CnH2n CnH2n CnH2n CnH2n-2 CnH2n-3 CnH2n-6
Прогнозирование критических свойств веществ и критериев подобия
Критические (жидкость-пар) температура (Tc) и давление (Рс) являются важнейшими свойствами, которые положены в основу современных методов прогнозирования, основанных на принципе соответственных состояний. Качество сведений о критических свойствах во многом определяет результативность прогноза свойств веществ, зависящих от межмолекулярных взаимодействий.
Характеристика ацетиленовых углеводородов
АЦЕТИЛЕНОВЫЕ УГЛЕВОДОРОДЫ (АЛКИНЫ) Ацетиленовыми углеводородами (алкинами) называются непредельные (ненасыщенные) углеводороды, содержащие в молекуле одну тройную связь и имеющие общую формулу CnH2n-2. Родоначальником гомологического ряда этих углеводородов является ацетилен HCCH.
Прогнозирование критической температуры. Алканы и алкены
Критическая температура изменяется нелинейно с изменением числа углеродных атомов в молекуле во всех гомологических группах. При расчете критической температуры для алканов и алкенов используют индексы молекулярной связности Рандича и метод Джобака.
Охрана труда
Определение температуры вспышки паров горючих жидкостей. Цель: определение температуры вспышки паров жидкостей в воздухе, классификация жидкостей по степени пожароопасности, установление категории производства по пожаровзрывоопасности.
Непредельные углеводороды ряда ацетилена алкины
Алкины — алифатические непредельные углеводороды, в молекулах которых между углеродными атомами имеется одна тройная связь. Углеводороды ряда ацетилена являются еще более непредельными соединениями, чем соответствующие им алкены (с тем же числом углеродных атомов). Это видно из сравнения числа атомов водорода в ряду:
Нормативы по охране труда
Лабораторные работы по определению некоторых нормативов по охране труда: коэффициент естественной освещенности, температура вспышки паров горючих жидкостей.
Химический состав нефти и газа
Что такое нефть и газ известно всем. И в то же время даже специалисты не могут договориться между собой о том, как образуются нефтяные залежи.
Насыщенные (предельные) ациклические соединения.
Номенклатура алканов, характеристика их физико-химических и пожароопасных свойств. Алкилы – одновалентные остатки алканов. Понятие алкилов, образование их названий. Физические свойства предельных углеводородов.
Насыщенные углеводороды
Номенклатура. Распространение в природе. Свойства. Физические свойства некоторых насыщенных углеводородов.
Непредельные углеводороды ряда ацетилена (алкины)
Алкины — алифатические непредельные углеводороды, в молекулах которых между углеродными атомами имеется одна тройная связь. Углеводороды ряда ацетилена являются еще более непредельными соединениями, чем соответствующие им алкены
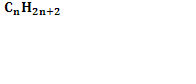
![]() . Диены являются структурными изомерами алкинов.
. Диены являются структурными изомерами алкинов.![]()
![]()


