.
Не так давно я вплотную столкнулся с расчетами коэффициента активности растворов электролитов. Нельзя сказать, что раньше я никогда не производил таких расчетов, однако сейчас у меня возникли некоторые вопросы, связанные с расчетами в области высоких концентраций.
Известно, что до ионной силы 0,01М коэффициент активности (f) хорошо описывается расширенной формулой Дебая-Хюккеля:
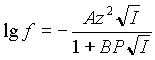 |
(1) |
где z - заряд иона;
I - ионная сила раствора;
P - параметр Килланда, зависящий от размера иона;
A = 0,509 при 250
С ;
B = 0,328 при 250
С .
Ионная сила раствора равна
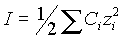 |
(2) |
где Ci
- концентрация ионов одного вида в исследуемом растворе.
Для области большей ионной силы, самой распространенной является следующая формула:
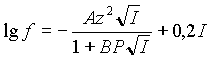 . . |
(3) |
Эта формула предполагает увеличение коэффициента активности после некоего значения ионной силы.
Большинство исследователей предпочитают в своих работах не упоминать об условиях, при которых следует от формулы (1) переходить к формуле (3). В связи с этим я предпринял собственные исследования, благо в моем распоряжении была программа IonCalc ( Программу можно получить здесь.).
Поскольку я располагал справочными данными ("Краткий химический справочник" В.А.Рабиновича и З.Я.Хавина, изд. "Химия",1977г.) об экспериментально полученных значениях коэффициента активности, то работа состояла в сопоставлении этих данных с расчет ными. Расчеты я производил по формуле (1), так как применение формулы (3) только усугубляло расхождение между экспериментальными и расчетными данными.
В справочнике приведены экспериментально полученные данные о среднем коэффициенте активности растворов солей. Средний коэффициент активности составляют коэффициенты активности аниона и катиона следующим образом:
f ср
m+n
= fM
m
+ fA
n
, где
fM
иfA
- коэффициенты активности катиона и аниона:
m и n - стехиометрические коэффициенты исследуемой соли Mm
An
.
Если распоряжаться этой формулой, то можно легко рассчитать средний коэффициент активности и сравнить его с экспериментальным.
Проведенные мной расчеты представлены в таблице, которая содержит сведения об относительной разнице в процентах между экспериментальными и расчетными данными. Относительная погрешность представлена в двух видах: среднеарифметическая величина погрешности (первое число) и максимальная погрешность в серии расчетов (второе число).
Таблица 1.*)
| I, M |
0,1 |
0,2 |
0,3 |
0,4 |
0,6 |
0,8 |
| MA 1)
|
1,8/2,8 |
3,6/5,9 |
- |
7,2/10 |
- |
- |
| MA2
2)
|
- |
- |
2,8/5 |
- |
5,8/7,5 |
- |
| M2
A 3)
|
- |
- |
3,8/5,5 |
- |
5,9/11 |
- |
| MSO4
4)
|
- |
- |
- |
- |
- |
76/91 |
| LaCl3
|
- |
- |
- |
- |
16 |
- |
| H3
PO4
|
- |
- |
- |
- |
16 |
- |
1)
AgNO3
, HCl, HNO3
, KBr, KCl, KOH, NaCl, NaOH, NH4
Cl, NaCH3
COO, NaNO3
, KNO3
.
2)
BaCl2
, CaCl2
, FeCl2
, MgBr2
, MgCl2
, Ca(NO3
)2
, Co(NO3
)2
, Cu(NO3
)2
.
3)
K2
CrO4
, K2
SO4
, Na2
CrO4
, (NH4
)2
SO4
, Na2
SO4
, Na2
CO3
, K2
CO3
.
4)
ZnSO4
, MgSO4
, MnSO4
, Cu SO4
.
Расчеты показывают, что для ионной силы в 0,3М максимальная погрешность составляет 5-6%.
Необъясненным остается тот факт, что коэффициент активности сульфатов двухзарядных металлов очень высок в сравнении с экспериментальными данными. Также высок средний коэффициент активности серной кислоты. Он составляет 0,266 для раствора с ионной силой 0,3 М, в то время как расчеты предоставляют величину 0,517.
Другие работы по теме:
Коэффициент трения и методы его расчета
Трение как процесс взаимодействия твердых тел при относительном движении либо при движении твердого тела в газообразной или жидкой среде. Виды трения, расчет трения покоя, скольжения и качения. Расчет коэффициентов трения для различных пар поверхностей.
Расчет процесса горения газообразного топлива
Расчет теоретического объёма расхода воздуха, необходимого для горения природного газа и расчет реального объёма сгорания, а также расчет теоретического и реального объёма продуктов сгорания. Сопоставление расчетов, используя коэффициент избытка воздуха.
Оценка деловой активности
Деловая активность является комплексной и динамичной характеристикой предпринимательской деятельности и эффективности использования ресурсов. Уровни деловой активности конкретной организации отражают этапы ее жизнедеятельности (зарождение, развитие, подъем, спад, кризис, депрессия) и показывают степень адаптации к быстроменяющимся рыночным условиям, качество управления.
Динамический расчет токарно-винторезного станка 16Б04А
Поиск собственных частот элементов токарно-винторезного станка и их резонансных амплитуд с помощью программы MathCAD. Массы и жёсткости компонентов. Расчет режимов резания и осевой силы. Корректировка скорости резания. Выбор необходимых коэффициентов.
Проверочный расчет станка С2Р12
Реферат СТАНОК, МУФТА, НОЖЕВОЙ ВАЛ, ВАЛЕЦ, ФУНКЦИОНАЛЬНАЯ СХЕМА, КИНЕМАТИЧЕСКАЯ СХЕМА, ТЯГОВАЯ СПОСОБНОСТЬ Курсовой проект состоит из пояснительной записки и 2 листов формата A1, 1 листа формата А2, 1 листа формата А3, 1 листа формата А4 (иллюстративного материала).
Тепловой расчет контейнера с естественной циркуляцией воздуха
Определение коэффициентов теплопроводности слоев. Расчет суммарного термического сопротивления, суммарного коэффициента теплопередачи от внутреннего воздуха к внутренней стенке, ряда параметров приблизительного расчета. Выполнение окончательного расчета.
«БиномНьютон а»
Задачи, сводящиеся к использованию формулы бинома Ньютона (нестандартные задачи по теме «Бином Ньютона»)
Трудовая активность
- реализация интеллектуального и физического потенциала рабочей силы в процессе трудовой деятельности. Количественная определенность трудовой активности выражается в достигнутом уровне производительности труда или объеме выполненной работы в единицу времени.
Планы второго порядка, реализация В3-плана
Метод планирования второго порядка на примере В3-плана. Получение и исследование математической модели объекта в виде полинома второго порядка. Статистический анализ полученного уравнения и построение поверхностей отклика. Расчет коэффициентов регрессии.
Алгебра матриц. Системы линейных уравнений
Выполнение действий над матрицами. Определение обратной матрицы. Решение матричных уравнений и системы уравнений матричным способом, используя алгебраические дополнения. Исследование и решение системы линейных уравнений методом Крамера и Гаусса.
Математический анализ. Регрессия
y=a уравнение регрессии. Таблица 1 1.35 1.09 6.46 3.15 5.80 7.20 8.07 8.12 8.97 10.66 Оценка значимости коэффициентов регрессии. Выдвигается и проверяется гипотеза о том что истинное значение коэффициента регрессии=0.
Красный цветок
Автор: Гаршин Всеволод. Самый знаменитый рассказ Гаршина. Не являясь строго автобиографическим, он тем не менее впитал личный опыт писателя, страдавшего маниакально-депрессивным психозом и перенесшего острую форму болезни в 1880 г.
Клит военачальник
Клит Черный (греч. Κλείτος, ок. 380—328 гг. до н. э.) — военачальник и личный друг Александра Великого.
Показатели, характеризующие финансовое состояние предприятия 2
Модуль 8.2. ПОКАЗАТЕЛИ, ХАРАКТЕРИЗУЮЩИЕ ФИНАНСОВОЕ СОСТОЯНИЕ ПРЕДПРИЯТИЯ Показатели, характеризующие финансовое состояние можно условно разделить на группы, отражающие различные стороны финансового состояния предприятия. К ним относятся коэффициенты ликвидности; показатели структуры капитала (коэффициенты устойчивости); коэффициенты рентабельности; коэффициенты деловой активности.
Ценообразование 6
Ценообразование — установление цен, процесс выбора окончательной цены в зависимости от себестоимости продукции, цен конкурентов, соотношения спроса и предложения и других факторов.
Расчет искусственного освещения производственных помещений
Задание Расчет искусственного освещения производственных помещений Важным фактором обеспечения комфортных условий труда является создание оптимального освещения производственных помещений, рабочих мест, участков производства работ вне зданий и территории предприятия в целом. Для искусственного освещения производственных помещений используют преимущественно люминесцентные лампы, а при высоте 12…14 м – дуговые ртутные лампы.
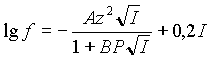 .
. 
